Carta al editor, Vol. 35, No. 5, Septiembre-Octubre 2019
Med Int Méx. 2019 septiembre-octubre;35(5):827-831. https://doi.org/10.24245/mim.v35i5.3438
José Luis Herrera-Torres
Especialista en Investigación Clínica. Farmacéutico.
Estimado editor:
Con respecto a la publicación como artículo original Diferencias farmacocinéticas entre rifaximina alfa y una rifaximina genérica, incluido en el volumen 35 (3) mayo-junio pp 370-378, es relevante describir las siguientes discrepancias metodológicas y de análisis de datos que consideramos sesga la conclusión del estudio.
Título de la publicación
El título de la publicación está sesgado para que se interprete como un estudio clínico, al no especificar que es una comparación farmacocinética preclínica en un modelo en perros Beagle, esta observación tiene mayor relevancia dada la especialización de la revista, que es de Medicina Interna.
Alteración de la forma farmacéutica comercializada de los medicamentos
Las tabletas de Arfla fueron pulverizadas para posteriormente preparar la dosis administrada de 100 mg/kg en dos cápsulas tamaño 13.
Dado el objetivo del estudio, que fue investigar si la farmacocinética de rifaximina de referencia (Flonorm) es distinta a Arfla, se debió haber utilizado un diseño que no requiriera manipular las características del medicamento, como lo fue la pulverización de la tableta, debieron usarse las mismas condiciones de administración que las utilizadas por los pacientes, es decir, en su forma farmacéutica original.
La pulverización de las tabletas provoca sesgo en la velocidad de disolución in vivo y, por tanto, en la evaluación de la permanencia del fármaco en el tubo gastrointestinal y su posible absorción.
Lo anterior sustentado en que Arfla (tabletas) demostró por medio de su desarrollo farmacéutico calidad, seguridad y eficacia ante COFEPRIS y en apego absoluto a los lineamientos del Consejo General de Salud de México, con lo que obtuvo su registro.
Evaluación farmacocinética
Inadecuada validación del método bioanalítico
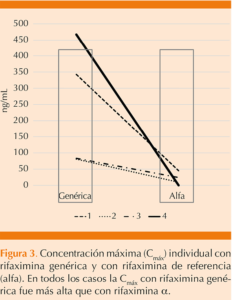
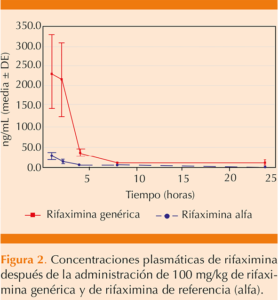
Se menciona que la linealidad se evaluó en el intervalo de 0.2490 a 99.61 ng/mL; sin embargo, los resultados descritos exceden dramáticamente el límite superior, en la Figura 3 se observa un valor de Cmáx mayor que 450 ng/mL y en la Figura 2, según los datos, hay valores mayores de 52,232 ng/mL.*
Los valores de concentración mayores al intervalo en donde se demostró linealidad (99.61 ng/mL) demuestran que el diseño del estudio fue incorrecto, no se justifica ni explica el manejo de las muestras para poder cuantificar valores mayores a 99.61 ng/mL.
En la Figura 2 se identifica que las escalas de los niveles de concentración tienen serios errores, se indica que las concentraciones van de 232 a 01232 ng/mL; sin embargo, hay valores intermedios de mayor magnitud, como 51,232 ng/mL, adicionalmente esta magnitud de resultados son totalmente inconsistentes a las magnitudes de Cmáx reportadas.

Tiempos de muestreo inadecuados para caracterizar el perfil farmacocinético
En la Figura 2 se identifica que los tiempos de muestro fueron inadecuados, ya que se observa que en el primer tiempo de muestreo en promedio se alcanzan los valores máximos sin observar la fase ascendente (absorción), lo cual genera una estimación inadecuada para los parámetros farmacocinéticos.*
Falta de estandarización o normalización de los parámetros farmacocinéticos por dosis administrada
Con base en que los parámetros farmacocinéticos Cmáx y ABC son dosis dependiente en los estudios de biodisponibilidad comparativa se debe administrar la misma cantidad de fármaco, de lo contrario, se requiere realizar una normalización o estandarización de los parámetros obtenidos en función de la cantidad real de fármaco administrado, lo que generalmente no es recomendable porque introduce variabilidad y debe demostrarse que en el intervalo de dosis administrada la farmacocinética es lineal.
En este estudio la dosis administrada fue individualizada a cada perro en función de su peso a 100 mg/kg; al considerar que los perros tuvieron un peso entre 8 y 11 kg, la dosis en teoría administrada varió entre 800 y 1100 mg, no se identifica en el artículo que los parámetros farmacocinéticos hayan sido estandarizados por la cantidad de fármaco administrado, tampoco se menciona que entre 800 y 1100 mg la farmacocinética de rifaximina sea lineal, para en su caso poder estandarizar los parámetros farmacocinéticos.
Alta variabilidad no explicada en los resultados
A partir de la Figura 3 se identifica que 50% de los perros utilizados (2) tuvieron valores de Cmáx para ARFLA menores que 80 ng/mL aproximadamente, por lo que la estimación de un promedio del orden de 244 ng/mL está sesgado por los valores altos que no son explicados y que pudieran ser debido a la incorrecta validación del método analítico, específicamente a la linealidad, previamente descrita.
Desde el punto de vista estadístico, para comparar dos perfiles farmacocinéticos deben presentarse intervalos de confianza para el cociente de los parámetros (prueba de Shuirmann) en donde también se requiere el valor de la potencia del análisis, con el fin de poder sustentar si el tamaño de la muestra y la variabilidad observada en el estudio son adecuados para concluir; esta información no se presenta, se ignora si esta ausencia es intencionada porque con un tamaño de muestra de cuatro perros y con la alta variabilidad observada es muy probable que la potencia del análisis estadístico indicara que el tamaño de la muestra es insuficiente para realizar las conclusiones con el grado de generalidad descrito.
Perfiles de disolución
Con base en que existen guías internacionales para realizar los perfiles de disolución para rifaximina, es de esperarse que la rifaximina sí tenga absorción sistémica, lo que está también sustentado en estudios que evalúan la farmacocinética en humanos, lo relevante para poder interpretar el comportamiento de los perfiles de disolución y extrapolar los resultados observados a un perfil farmacocinético es analizar los resultados con base en la permeabilidad y solubilidad de rifaximina, aspecto que no se menciona en la publicación, ni los argumentos estadísticos-matemáticos que son requeridos para una correlación in vivo-in vitro.
A partir de los datos mostrados no se observa si el coeficiente de variación es aceptable para compararlos a partir del factor de similitud f2.
Análisis de seguridad con base en los resultados farmacocinéticos observados en un modelo preclínico
Es inadecuado que de acuerdo con los resultados farmacocinéticos obtenidos en este modelo preclínico se hagan inferencias y conclusiones de la seguridad de Arfla, con base en hipótesis del autor, cuando existe fundamento científico de la baja correlación de la biodisponibilidad preclínica a la clínica.
Jennifer B Dressman describe en su artículo Comparison of canine and human gastrointestinal physiology, Pharmaceutical Research 1986;3(3):123-131; así como Steven C Sutton en su publicación intitulada Companion animal physiology and dosage form performance, en Advanced Drug Delivery Reviews 2004;56:1383-1398, que existen diferencias entre animales (perros por ejemplo) y humanos con respecto al tiempo de tránsito gastrointestinal, influencia de los hábitos alimenticios, pH gástrico, enzimas intestinales, permeabilidad gastrointestinal y regiones de absorción que tienen, por tanto, un efecto también diferente en el desempeño de las formulaciones que son administradas por vía oral, de manera que lo que se observa en modelos animales no necesariamente se reproduce en humanos.
Helen Musther y su grupo, en su artículo Animal versus human oral drug bioavailability: Do they correlate?, European Journal of Pharmaceutical Sciences 2014;57:280-291, realizó un análisis extenso de datos publicados en la bibliografía científica para determinar si existe correlación entre la biodisponibilidad en humanos y en animales, encontraron que la biodisponibilidad animal no es cuantitativamente predictiva de la biodisponibilidad humana.
Por último, es relevante mencionar que existen medicamentos genéricos de rifaximina (diferentes al polimorfo alpha) comercializados internacionalmente (Europa), cuyos niveles de concentración plasmática en humanos han sido diferentes a rifaximina alpha, sin que este hecho represente ningún inconveniente, por ser un medicamento de acción local, permitiendo alternativas terapéuticas para los pacientes y médicos en apego a las políticas de salud pública.
Diferencias farmacocinéticas entre rifaximina alfa y una rifaximina genérica. Respuesta a carta al editor
Sr. Editor:
En respuesta a la carta al editor sobre el artículo “Diferencias farmacocinéticas entre rifaximina alfa y una rifaximina genérica”, comentamos lo siguiente:
a. Respecto al título del estudio, sigue las políticas editoriales que no especifican que debe ser un estudio clínico. Además, en el resumen se evidencia que se trata de un estudio de farmacocinética en perros después de la administración única.
b. En el desarrollo preclínico de rifaximina, los experimentos se llevaron a cabo suministrando dosis del activo por kilogramo de peso del animal. En las buenas prácticas preclínicas, la administración por kilogramo es la más utilizada. Asimismo, por homogeneidad con otros estudios preclínicos, fue necesario proceder a la pulverización de los comprimidos de ambos medicamentos que se trataron de la misma manera: su pulverización en un mortero llevó a obtener un polvo que refleja las características del principio activo en cuanto al polimorfismo, como se evidenció por difracción de rayos X reportada en el artículo. Por lo tanto, la pulverización no modificó las características del activo.
c. Inadecuado método bio-analítico.
1. Ciertamente el método se validó en el intervalo informado, pero durante la validación del método analítico es usual validar las diluciones de las muestras fuera del intervalo cuando se puede esperar que las absorciones salgan del límite máximo de linealidad. Esto permite medir valores mayores de 99.96 ng/mL. Esto es un procedimiento normal que forma parte de la validación del método bio-analítico.
2. Algunas observaciones de la carta recibida derivan de las mediciones reflejadas en la Figura 2. A este respecto, en la publicación apareció un error en la escala de medición de la gráfica (Figura 2), la cual fue enviada y debe ser como aparece en la siguiente página.

3. En los animales es común normalizar la dosis por peso corporal. De todas formas, se suministran todos los elementos para interpretar los resultados. El estudio tiene un diseño experimental cruzado por lo que cada perro recibió ambos productos: rifaximina alfa y rifaximina kappa, con un periodo de una semana de wash out entre los dos. Durante este lapso de tiempo el peso de cada animal permaneció sin cambios, por lo que individualmente cada perro recibió la misma dosis de rifaximina alfa y de rifaximina kappa, también en valor absoluto. Mas allá del bajo número de la muestra y teniendo en cuenta que cada perro resultó ser el control de sí mismo, las concentraciones sistémicas de rifaximina kappa fueron más altas en cada perro respecto a las alcanzadas con rifaximina alfa, lo que sugiere mayor exposición sistémica después de la administración de rifaximina kappa que de rifaximina alfa.
d. Para la comparación de los perfiles de disolución se aplicó la “Draft guidance on rifaximin” (FDA revised Mar 2017), que prevé la utilización de la prueba ƒ2 para definir la similitud de esos perfiles. La “Guideline on the investigation of bioequivalence” prevé que el CV relativo al primer punto del perfil de disolución (inferior a 15 min) sea menor a 20%, mientras que para los puntos sucesivos debe ser menor a 10%.
La prueba con Flonorm está conforme a esos requisitos, mientras que la prueba con Arfla no los respeta en cuanto a que los valores de CV relativos al primer punto en todas las condiciones probadas son superiores al límite (Flonorm rango CV: 7-9%; Arfla rango CV 22-37%). Este dato sugiere la escasa consistencia del producto Arfla.
Se decidió igualmente proceder a la comparación, ya que el valor medio relativo en la muestra a los 10 minutos (primer punto) es aquel en el que los dos perfiles muestran un porcentaje de disolución comparable, al contrario de los valores medios sucesivos que fueron significativamente diferentes.
Además, el estudio no tiene fines de registro sanitario, pero se efectuó para comparar las dos formulaciones que resultaron distintas en todas las condiciones probadas.
e. Análisis de seguridad. No tenemos conocimiento de estudios clínicos de comparación de polimorfos de rifaximina, distintos del polimorfo alfa, que confirmen la eficacia y la seguridad de los mismos. Al final del artículo, se expresa claramente que se trata de un estudio en animales y no trasladable directamente al humano.
Atentamente
Fiorella Calanni, Mascia Federici, Maria Grimaldi, Paola Maffei, Marco Mascagni, Gabriela Alejandra Marzoli y Giuseppe Claudio Viscomi.
_______________________________________
* La Figura 2 fue enviada correctamente por los autores, pero por un error involuntario por parte de la editorial se publicó con errores, la Figura 2 se reproduce en la página 831 de manera correcta.
Sin comentarios