La evolución del tratamiento farmacológico contra COVID-19
The evolution of pharmacological treatment of COVID-19.
Med Int Méx. 2021; 37 (5): 842-845. https://doi.org/10.24245/mim.v37i5.4624
Luis Del Carpio-Orantes
Departamento de Medicina Interna, Hospital General de Zona núm. 71, Instituto Mexicano del Seguro Social, Veracruz, Ver., México.
Los primeros casos de neumonía por un nuevo coronavirus, hoy denominado SARS-CoV-2, y su entidad nosológica COVID-19, se reportaron en Wuhan, China, a finales de 2019. Adquirió rápidamente el título de pandemia por su distribución por el globo terráqueo en cuestión de días, actualmente ha llegado a afectar a más de 20 millones de personas en 188 países y con casi 800,000 defunciones, siendo una enfermedad aún sin un tratamiento específico y sin una vacuna que asegure inmunidad. Siendo una enfermedad nueva, emparentada con los coronavirus pandémicos SARS-CoV-1 y MERS CoV, que condicionan cuadros neumónicos graves con insuficiencia respiratoria aguda y elevada mortalidad, la preocupación mundial fue tener un tratamiento efectivo contra dichas manifestaciones intentando evitar la mayor morbilidad y mortalidad posibles.1
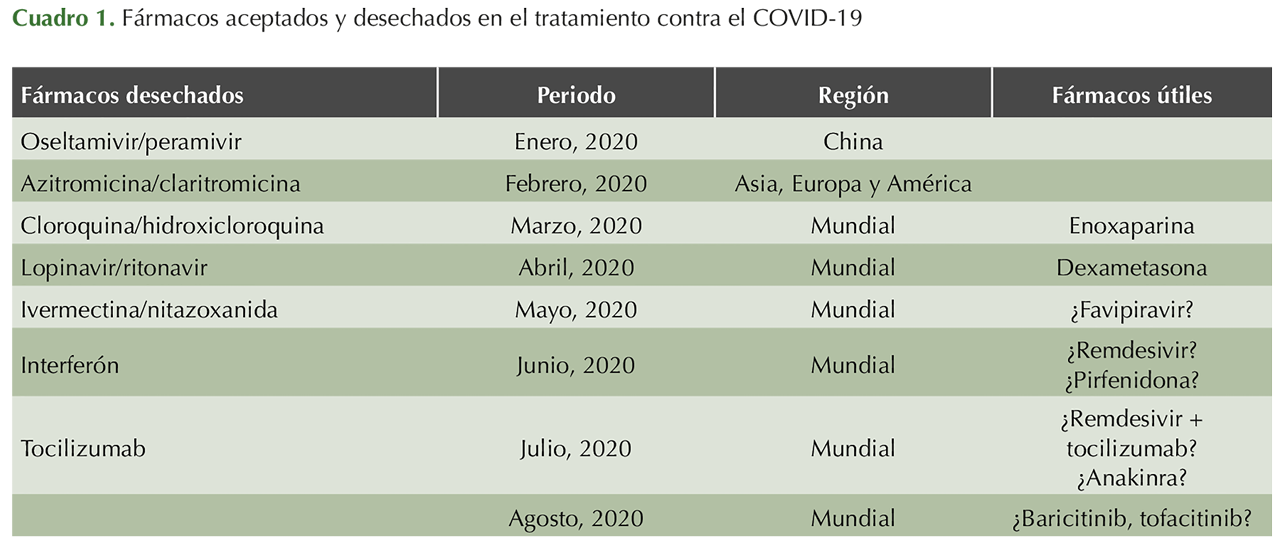
Los primeros fármacos que comenzaron a prescribirse eran conocidos por sus cualidades antivirales en otras enfermedades, como influenza, o administrados durante las pandemias de SARS y MERS de donde se inició la prescripción de los inhibidores de neuraminidasas (oseltamivir, peramivir), otros fármacos contra virus de la familia herpesviridae (aciclovir, valganciclovir), fármacos antihepatitis (ribavirina, interferón) y antirretrovirales prescritos en el VIH/SIDA (lopinavir/ritonavir, darunavir, emtricitabina-tenofovir); posteriormente, con base en la relativa utilidad durante las pandemias de SARS y MERS otros fármacos hicieron su aparición, principalmente macrólidos (destacando azitromicina) y antimaláricos (cloroquina, hidroxicloroquina), que solos o en combinación prometían buenos resultados, mismos que nunca pudieron corroborarse alegándose toxicidad, principalmente en conjunción con otros fármacos. En esas épocas destacó, además, la retractación de algunos documentos al respecto incluso de prestigiosas revistas debido a que hubo incongruencias en cuanto a sus recomendaciones. Destaca que en los grandes repositorios de ensayos clínicos (clinicaltrials.gov) todavía hay estudios en fase de captación de pacientes o con resultados aún por darse a conocer.2-5
A medida que avanzaba la pandemia por las naciones europeas y ya con invasión americana, otros fármacos fueron sometidos a escrutinio, tocando el turno ahora a antiparasitarios (ivermectina, nitazoxanida) que por su actividad in vitro con otros coronavirus pandémicos conocidos se prescribieron teniendo el mismo destino, actualmente descartados.6,7,8
En contraparte los primeros fármacos que prometieron beneficio principalmente en pacientes con neumonía grave e hipoxia fueron los esteroides (dexametasona y metilprednisolona), mismos que aún gozan de dicha indicación y beneficio a partir de los resultados del estudio Recovery.9,10
A la par de éstos, otros fármacos que se implementaron –conociéndose ahora una etapa de hiperinflamación que en conjunto con la activación de la cascada de la inflamación ocurría en forma concomitante a la activación de la coagulación y que son responsables de la etapa pulmonar e inflamatoria de la enfermedad que conlleva alta mortalidad por eventos tromboembólicos agregados– fueron la heparina de bajo peso molecular (enoxaparina primordialmente) que además de su efecto antitrombótico tiene otros efectos importantes contra esta enfermedad, como el efecto inmunomodulador, antiangiogénico, anticomplementémico, antitumoral y antifibrótico, así como los antagonistas de los receptores de IL-6 con su principal exponente: tocilizumab. Con este último fármaco al inicio de su administración hubo varios estudios que avalaban su función; sin embargo, en julio de 2020 la misma farmacéutica que lo produce emitió un comunicado con base en un estudio realizado por ellos mismos en el que decían que la efectividad de tocilizumab era nula al no conseguir mejorar el curso clínico ni la supervivencia (estudio COVACTA); sin embargo, curiosamente otro brazo de estudio menciona que al parecer la terapia combinada con remdesivir y tocilizumab podría tener beneficios (estudio REMDACTA) y otro más aún en proceso en pacientes con neumonía moderada a grave que ameritan estancia hospitalaria está en proceso (estudio EMPACTA).11-18
Asimismo, el mencionado remdesivir (fármaco que demostró utilidad en SARS, MERS y Ébola) al parecer es de los pocos antivirales que han tenido efectos positivos (mejorando la supervivencia en 68%) aunado al favipiravir, de fabricación rusa; ambos han demostrado acortar el curso clínico y disminuir la progresión de la enfermedad a formas severas, así como mejorar el pronóstico; actualmente se distribuyen en América; sin embargo, el alto costo del primero (aunado a que prácticamente fue acaparado por Estados Unidos) y las dificultades de importación del segundo han hecho difícil su presencia como opción terapéutica.19,20
Tras el desprestigio del tocilizumab (aún prescrito con fines de rescate en pacientes graves) entraron en juego otros fármacos conocidos como Jakinibs (tofacitinib, baricitinib), que al inhibir la vía de señalización de citocinas vía la inhibición de la janus cinasa (JAK), se logra disminuir la respuesta inmunitaria. Sin embargo, se están viendo fenómenos de inmunosupresión, incluso mayores que con tocilizumab, que han favorecido infecciones agregadas, principalmente micóticas.21,22
Otros fármacos que intentan situarse como adecuados para el tratamiento de COVID-19 son anakinra, que es un antagonista del receptor de IL-1 que tendría importancia al inhibir la respuesta hiperinmunitaria, ya se ha recomendado en pacientes que no han respondido a otros antiinflamatorios como tocilizumab; de igual forma a pirfenidona, un fármaco con acción antifibrótica pulmonar, se le han conferido otras ventajas, como inhibir la apoptosis, regulación negativa de la expresión de los receptores ACE2, disminuir la inflamación y el estrés oxidativo, que finalmente llevaría a la protección de los neumocitos y otras células afectadas por el SARS-CoV-2.23,24
Por último, algunas entidades gubernamentales y en salud han comenzado a “satanizar” a los profesionales de la salud por toda esta vorágine condicionada por la pandemia, en la que no se ha tenido tiempo de llevar a cabo grandes ensayos clínicos controlados con distribución al azar y en la que se han redoblado esfuerzos y actuado a través del ensayo error que, dicho sea de paso, es un método heurístico para obtener conocimientos que se usa en farmacología (para obtención de nuevos fármacos) y en el método científico (durante la formulación de hipótesis), por lo que su utilidad debe ser aceptada y tales entidades no deberían confundir a la población con comentarios desleales en los que la imagen del profesional de la salud ve mermada su integridad y puede ser sujeto de agresiones físicas o procesos legales que la misma pandemia ha favorecido.
La pandemia por COVID-19 sigue su apabullante curso por todo el planeta (actualmente en fase 3-4 de la OMS) y el médico, tratante de los afectados, sigue en su ejercicio ensayo-error (en espera de poder formular ensayos clínicos con distribución al azar) y de aprendizaje a través de él prescribiendo medicamentos en uso compasivo, que es una estrategia en la que se prescriben fármacos que han demostrado cierta utilidad antes de ser debidamente autorizados por las autoridades regulatorias, aguardando la esperanza de encontrar un fármaco eficaz y ulteriormente una vacuna efectiva que ayude al control total de la pandemia siempre bajo la máxima primum non nocere. Es factible que muchos más fármacos salgan a la luz como prometedores de eficacia frente al SARS-CoV-2 o sus complicaciones y, de igual manera, otros medicamentos serán borrados de la lista por no demostrar utilidad, lo cual no traduce mala praxis, falta de ética o moral de los profesionales de la salud, sino un intento desesperado por detener la pandemia y recuperar vidas humanas, lo cual debe ser reconocido dentro del espíritu de humanismo.
REFERENCIAS
1. Del Carpio-Orantes L. Del 2019-nCoV al COVID-19, caracterizando la enfermedad. Med Int Méx 2020; 36 (3): 414-417. https://doi.org/10.24245/mim.v36i3.4009.
2. Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. Pharmacologic treatments for coronavirus disease 2019 (COVID-19): A review. JAMA 2020; 10.1001/jama.2020.6019. doi:10.1001/jama.2020.6019.
3. Wu R, Wang L, Kuo HD, Shannar A, et al. An update on current therapeutic drugs treating COVID-19. Curr Pharmacol Rep 2020; 1-15. doi. 10.1007/s40495-020-00216-7.
4. Siemieniuk RA, Bartoszko JJ, Ge L, Zeraatkar D, et al. Drug treatments for covid-19: living systematic review and network meta-analysis. BMJ 2020; 370: m2980. doi. 10.1136/bmj.m2980.
5. Li H, Wang YM, Xu JY, Cao B. . Zhonghua Jie He He Hu Xi Za Zhi 2020; 43 (3): 170-172. doi:10.3760/cma.j.issn.1001-0939.2020.03.004.
6. Caly L, Druce JD, Catton MG, Jans DA, Wagstaff KM. The FDA-approved drug ivermectin inhibits the replication of SARS-CoV-2 in vitro. Antiviral Res 2020; 178: 104787. doi:10.1016/j.antiviral.2020.104787.
7. Schmith VD, Zhou JJ, Lohmer LRL. The approved dose of ivermectin alone is not the ideal dose for the treatment of COVID-19. Clin Pharmacol Ther 2020; 10.1002/cpt.1889. doi:10.1002/cpt.1889.
8. Pepperrell T, Pilkington V, Owen A, Wang J, Hill AM. Review of safety and minimum pricing of nitazoxanide for potential treatment of COVID-19. J Virus Erad 2020; 6 (2): 52-60. doi:10.1016/S2055-6640(20)30017-0.
9. Fadel R, Morrison AR, Vahia A, Smith Z, et al. Early short course corticosteroids in hospitalized patients with COVID-19. Clin Infect Dis 2020; ciaa601. doi:10.1093/cid/ciaa601.
10. RECOVERY Collaborative Group, Horby P, Lim WS, et al. Dexamethasone in hospitalized patients with Covid-19 – Preliminary report. N Engl J Med 2020; 10.1056/NEJMoa2021436. doi:10.1056/NEJMoa2021436.
11. Porfidia A, Pola R. Venous thromboembolism in COVID-19 patients. J Thromb Haemost 2020; 18 (6): 1516-1517. doi:10.1111/jth.14842.
12. Cattaneo M, Morici N. Is thromboprophylaxis with high-dose enoxaparin really necessary for COVID-19 patients? A new “prudent” randomised clinical trial. Blood Transfus 2020; 18 (3): 237-238. doi:10.2450/2020.0109-20.
13. Xu X, Han M, Li T, Sun W, et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci USA. 2020; 117 (20): 10970-10975. doi:10.1073/pnas.2005615117.
14. Alzghari SK, Acuña VS. Supportive treatment with tocilizumab for COVID-19: A systematic review. J Clin Virol 2020; 127: 104380. doi. 10.1016/j.jcv.2020.104380
15. A study to evaluate the safety and efficacy of tocilizumab in patients with severe COVID-19 pneumonia (COVACTA). https://clinicaltrials.gov/ct2/show/NCT04320615.
16. Roche provides an update on the phase III COVACTA trial of Actemra/RoActemra in hospitalised patients with severe COVID-19 associated pneumonia. https://www.roche.com/investors/updates/inv-update-2020-07-29.htm
17. A study to evaluate the efficacy and safety of remdesivir plus tocilizumab compared with remdesivir plus placebo in hospitalized participants with severe COVID-19 pneumonia (REMDACTA). https://clinicaltrials.gov/ct2/show/NCT04409262.
18. EMPACTA trial. A study to evaluate the efficacy and safety of tocilizumab in hospitalized participants with COVID-19 pneumonia. https://clinicaltrials.gov/ct2/show/NCT04372186.
19. Grein J, Ohmagari N, Shin D, Diaz G, et al. Compassionate use of remdesivir for patients with severe Covid-19. N Engl J Med 2020; 382 (24): 2327-2336. doi. 10.1056/NEJMoa2007016
20. Coomes EA, Haghbayan H. Favipiravir, an antiviral for COVID-19? J Antimicrob Chemother 2020; 75 (7): 2013-2014. doi:10.1093/jac/dkaa171.
21. Cantini F, Niccoli L, Matarrese D, Nicastri E, Stobbione P, Goletti D. Baricitinib therapy in COVID-19: A pilot study on safety and clinical impact. J Infect 2020; 81 (2): 318-356. doi:10.1016/j.jinf.2020.04.017.
22. Seif F, Aazami H, Khoshmirsafa M, et al. JAK inhibition as a new treatment strategy for patients with COVID-19. Int Arch Allergy Immunol 2020; 181 (6): 467-475. doi:10.1159/000508247. 2020;181(6):467-475.
23. Dimopoulos G, de Mast Q, Markou N, Theodorakopoulou M, et al. Favorable anakinra responses in severe Covid-19 patients with secondary hemophagocytic lymphohistiocytosis. Cell Host Microbe 2020; 28 (1): 117-123.e1. doi:10.1016/j.chom.2020.05.007
24. Seifirad S. Pirfenidone: A novel hypothetical treatment for COVID-19. Med Hypotheses 2020; 144: 110005. doi:10.1016/j.mehy.2020.110005.
Recibido: 11 de agosto 2020
Aceptado: 11 de agosto 2020
Este artículo debe citarse como: Del Carpio-Orantes L. La evolución del tratamiento farmacológico contra COVID-19. Med Int Méx. 2021; 37 (5): 842-845.
Sin comentarios