Nuevas perspectivas para el tratamiento ambulatorio o en etapas tempranas de COVID-19
Volumen 36, 2020
Editor: Manuel Ramiro H.
ISSN: 0186-4866
Abreviatura: Med Int Méx. 2020;36
Nuevas perspectivas para el tratamiento ambulatorio o en etapas tempranas de COVID-19
New perspectives for the ambulatory or early treatment of COVID-19.
Med Int Méx. 2020;36:1-9. http://doi.org/10.24245/mim.v36id.4138
Brenda L Zúñiga-Blanco,1 Lucía G Pruneda-Álvarez,2 María de Lourdes Enríquez-Macías,3 Jamie Fyda4
1 Doctora en Medicina, Facultad de Medicina, Universidad Autónoma de San Luis Potosí, San Luis Potosí, SLP, México.
2 Doctora en Ciencias Biomédicas, Coordinación para la Innovación y Aplicación de la Ciencia y la Tecnología, Universidad Autónoma de San Luis Potosí, San Luis Potosí, SLP, México.
3 Doctora en Ciencias Biomédicas, Facultad de Medicina, Universidad Autónoma de San Luis Potosí, San Luis Potosí, SLP, México.
4 Doctor en Medicina, Facultad de Medicina, Universidad Evangélica de El Salvador, San Salvador, El Salvador.
Resumen
SARS-CoV-2 es un nuevo tipo de coronavirus, agente etiológico de la enfermedad por coronavirus 2019 (COVID-19), identificada en China en diciembre de 2019. La enfermedad se distribuyó rápidamente en todo el mundo, de tal suerte que la OMS la declaró pandemia el 12 de marzo de 2020. Desde entonces, los esfuerzos de las autoridades sanitarias internacionales se han centrado en el diagnóstico adecuado, el aislamiento de los pacientes y la búsqueda de terapias capaces de contrarrestar los efectos más graves de la enfermedad. A pesar de las duras medidas de contención, la propagación de este virus está en curso de manera exponencial. De acuerdo con la OMS, hasta el 7 de abril de 2020, COVID-19 ha causado más de 1,300,000 casos confirmados y cerca de 72,000 muertes en el mundo; en México, se han registrado 2439 casos confirmados y 125 defunciones. En ausencia de una terapia eficaz conocida y debido a la situación emergente en salud pública, es prioritario el desarrollo de nuevas terapias para tratar a los pacientes sintomáticos, además de encontrar la manera de disminuir la carga viral en portadores con su subsecuente transmisión. Están en estudio varios medicamentos: cloroquina, hidroxicloroquina y azitromicina, estos tres en conjunto con el interferón α, ribavirina, remdesivir, favipiravir, teicoplanina, melatonina e imatinab a dosis específicas se encuentran en investigación para confirmar su eficacia y seguridad para tratar pacientes infectados con COVID-19.
PALABRAS CLAVE: COVID-19; virus SARS; nuevo Coronavirus; pandemia; agentes antivirales; SARS CoV2.
Abstract
In December 2019, a novel coronavirus known as SARS-CoV-2, emerged in Wuhan, China, causing the respiratory illness COVID-19. The WHO declared COVID-19 as Pandemic on March 12th, 2020. Therefore, the global public health authorities, research and medical communities have relied on quarantine, isolation, instauring adequate diagnosis and on supportive care for those who become ill, in order to decrease the severity of COVID-19. Regardless of these infection-control measures, to prevent the spread of the disease, the transmission of this virus is exponentially growing, hence, we require a specific antiviral agent. Until April 7, 2020, according to the WHO, there are globally more than 1,300,000 confirmed cases of COVID-19 and nearly 72,000 deaths. In Mexico, we are facing 2439 cases and 125 deaths and rising. Therefore, it is urgent to treat the infected and optimally decrease viral shedding and subsequent transmission of SARS-CoV-2. Scientists around the world are endeavoring to find specific antivirals for the virus. Several drugs such as Chloroquine, Hidroxicloroquine, Azithromycin, Interferon α, Ribavirin, Remdesivir, Favipiravir, Teicoplanin, Melatonin and Imitinab are currently undergoing clinical studies to test their efficacy and safety in the treatment of COVID-2019.
KEYWORDS: COVID-19; SARS Virus; Novel Coronavirus; Pandemic; Antiviral Agent; SARS CoV2.
ANTECEDENTES
Desde el primer reporte de la enfermedad en Wuhan, China, el 31 de diciembre de 2019, COVID-19 se ha distribuido rápidamente en todo el mundo, declarándose pandemia el 12 de marzo de 2020 por la OMS. En la bibliografía se asienta que alrededor de 80% de los casos tienen enfermedad leve, con letalidad incluso de 8% en pacientes mayores de 70 años. De acuerdo con la OMS, al 7 de abril de 2020 COVID-19 había causado más de 1,300,000 casos confirmados y cerca de 72,000 muertes; en México, el registro es de 2439 casos confirmados y 125 decesos. Además, ha afectado socioeconómicamente a millones de personas en todo el mundo como consecuencia de las medidas de aislamiento y cuarentenas. Entre más rápido se logre contener la propagación del virus, más rápidamente se podrán revertir los graves daños colaterales pronosticados en el sistema de salud y la economía global, sobre todo para los países del tercer mundo.1 Por este motivo, y para limitar la trasmisión en la comunidad, es urgente encontrar un tratamiento efectivo para pacientes sintomáticos que disminuya la duración del virus en los portadores, reportado hasta el momento de 20 a 37 días.2 Para sumarnos al esfuerzo en investigación y contribuir a descubrir una posible terapia efectiva, los autores nos dimos a la tarea de analizar los datos publicados de SARS-CoV-2 y tratamiento de COVID-19.
La metodología aplicada consistió en un análisis exhaustivo de la bibliografía del tema reunida en las bases de datos: ISOC, PubMed, Medline, CAS, Google Académico y Latindex. Se descartaron las publicaciones que solo hacen análisis de correlación sin presentar un resultado válido. El objetivo fue: recabar información y la evidencia científica para proveer una revisión del tema y sugerencias para el adecuado tratamiento antiviral de COVID-19.
El 28 de enero de 2020 la OMS publicó un documento en el que especificaba las medidas para reconocimiento y clasificación de los pacientes con enfermedad respiratoria severa aguda, así como las estrategias para prevención y control de la infección, tratamiento de soporte y monitoreo tempranos y una guía para diagnóstico por laboratorio, tratamiento de la insuficiencia respiratoria y choque séptico, prevención de complicaciones y consideraciones para mujeres embarazadas.3
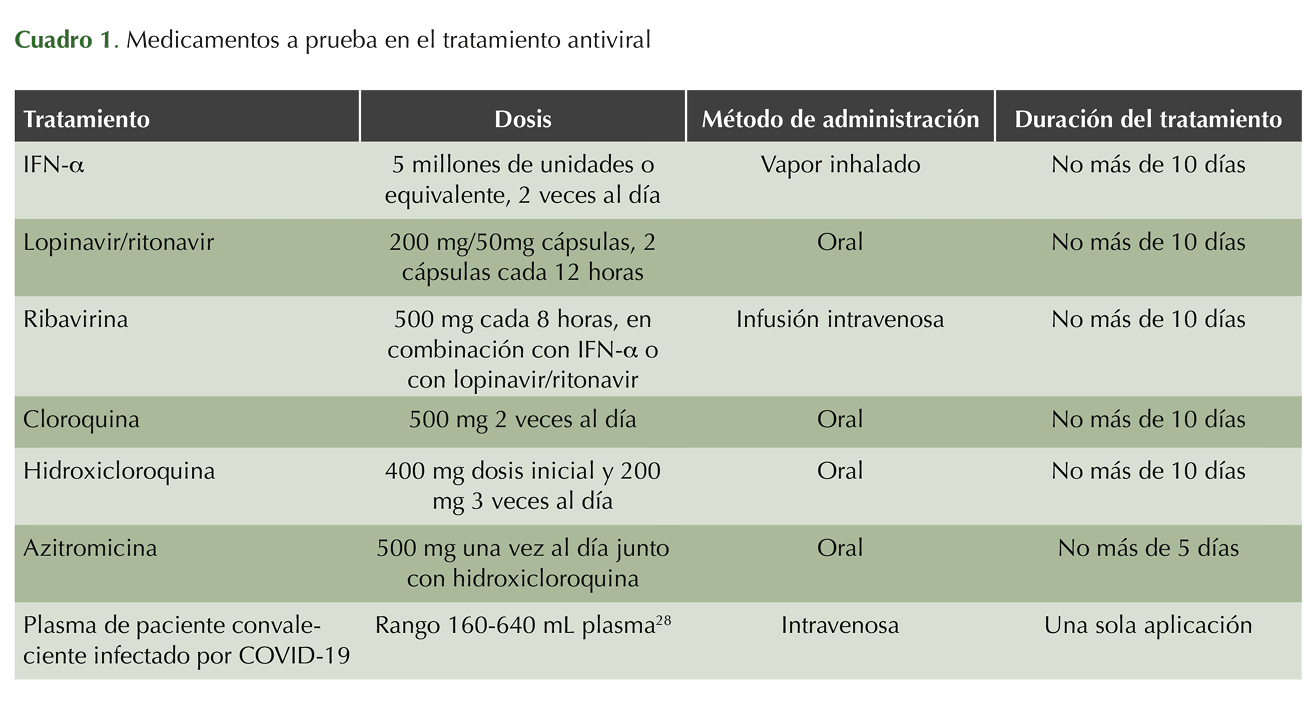
Los coronavirus son virus relativamente largos de cadena simple de ARN de polaridad positiva, encapsulados. Existen cuatro clases de coronavirus, clasificados como alfa, beta, gamma y delta. Los β-coronavirus incluyen los virus MERS, SARS-CoV y SARS-CoV-2.4 El causante de COVID-19, SARS-CoV-2, ataca las vías respiratorias bajas causando neumonía viral, pero además afecta el sistema gastrointestinal, hígado, corazón, riñones y sistema nervioso central ocasionando insuficiencia orgánica múltiple.4 Los β-coronavirus codifican para varias proteínas estructurales, entre ellas la proteína S (Spike) que funciona como inductor mayor de la respuesta inmunitaria en el huésped.1 Esta proteína media la invasión celular al unirse a los receptores ECA2 localizados en la superficie de la membrana celular.1,5,6 Además, el genoma de los coronavirus codifica para otras proteínas no estructurales: ARN polimerasa dependiente de ARN (RdRp), la proteasa 3CLpro y la proteasa parecida a papaína (PLpro). Todos éstos son objetivos en el desarrollo e investigación de múltiples medicamentos:7 cloroquina, hidroxicloroquina, azitromicina, interferón α, ribavirina, remdesivir, favipiravir, teicoplanina y melatonina a dosis específicas, para verificar su eficacia y seguridad en el tratamiento de COVID-19, como parte de una estrategia económica eficiente para proponer tratamientos con medicamentos ya existentes (Cuadro 1).
El nucleótido análogo inhibidor de ARN polimerasa dependiente de ARN, remdesivir,8,9 es un compuesto que se encuentra en investigación debido a su importante efectividad contra MERS-CoV y SARS-CoV. Este compuesto se convierte en remdesivir trifosfato, un análogo de adenosina que actúa como inhibidor de las ARN polimerasas dependientes de ARN (RdRps) al competir con ATP para su incorporación en la formación de nuevas cadenas de ARN, una vez incorporado, genera la terminación de la síntesis de ARN en la posición i+3.10 Se ha utilizado en Estados Unidos, Japón y varios países de Europa; sin embargo, hasta ahora no hay resultados contundentes que sugieran su eficacia y se esperan nuevos resultados de los ensayos en curso.9,10
Ribavirina9 es un antiviral que inhibe la guanilación del ARN mensajero viral, adicionalmente, inhibe la actividad de la ARN polimerasa; su administración ha demostrado disminución del riesgo de padecer enfermedad respiratoria severa.7
Lopinavir10 pertenece a los inhibidores de proteasa y se ha estudiado para inhibir a las proteasas 3CLpro (específica para SARS-Cov 2) y PLpro que son responsables de la escisión de los péptidos virales en unidades funcionales, sugiriendo la inhibición del ciclo viral. Aunque de manera aislada no ha dado resultados favorables en contra del SARS-CoV-2, múltiples autores sugieren la combinación de lopinavir con ritonavir,10,11 con base en la acción de lopinavir contra la proteasa 3CL y el efecto de ritonavir al incrementar la biodisponibilidad del medicamento al inhibir su degradación por la enzima CYP3A4 y se han estudiado en conjunto con interferón β prescritos en el tratamiento de MERS-CoV.11 En un estudio conducido por Cao y su grupo se incluyeron 199 pacientes, de los que se trataron de manera aleatoria a 99 pacientes con lopinavir/ritonavir 400 mg/100 mg vía oral dos veces al día por 14 días, más terapia estándar. Los 100 pacientes restantes funcionaron como control, su tratamiento fue solo convencional, que consistió en oxígeno suplementario, ventilación asistida y no asistida, antibióticos y vasopresores. Una vez concluido el periodo establecido, se analizó la efectividad de cada uno en los dos grupos, concluyendo que no existe aceleración significativa en la mejoría clínica, reducción de la mortalidad o disminución en la carga viral en pacientes con COVID-19 severa.12
Durante una infección viral, destacan dentro del grupo de las citocinas, los interferones, debido a su capacidad para interferir con la replicación viral. Los interferones se han prescrito para el tratamiento de infecciones virales por más de 20 años; tal es el caso del interferón α, en proceso de investigación, por su conocida eficacia en el tratamiento de hepatitis, además de que inhibe la reproducción de SARS-CoV-2 in vitro.7,13,14
La tormenta de citocinas se ha correlacionado con la severidad de la enfermedad causada por SARS-CoV-2. Los pacientes admitidos a terapia intensiva han mostrado altas concentraciones de citocinas proinflamatorias, particularmente MCP1, G-CSF y TNF-α, así como IL-4 e IL-10 secretadas por linfocitos Th2.7,13,14
Tocilizumab, un bloqueador de IL-6, demostró efectividad en el tratamiento de 20 pacientes con manifestaciones severas de COVID-19, regulando la concentración de linfocitos y PCR al cabo de 5 días de tratamiento, lo que puede atribuirse al bloqueo de la respuesta inflamatoria y febril asociada con IL-6.13
El inhibidor de BCR-ABL, imatinib,15 y el inhibidor JAK barcitinib16 se han propuesto como tratamiento por su actividad contra coronavirus al inhibir la fusión de los viriones con la membrana endosomal15 y al intervenir con el proceso inflamatorio, respectivamente; sin embargo, los ensayos clínicos aún no tienen resultados.
La cloroquina se ha propuesto para el tratamiento de pacientes con infecciones virales17,18 porque alcaliniza el pH fagolisosomal; además, debilita la liberación de transferrina de iones de hierro con lo que interrumpe la replicación viral. La cloroquina también ha demostrado reducir la exacerbación de neumonía y duración de sus síntomas.19,20 Como efectos adversos cardiovasculares se han reportado: trastornos de la conducción e insuficiencia cardiaca por antimaláricos, sobre todo en tratamientos a largo plazo, como bloqueos de la conducción aurículo ventricular o bloqueos de rama, mientras que el daño miocárdico se manifiesta con un patrón restrictivo e hipertrofia biventricular.20
La hidroxicloroquina21 interfiere con la función de fagocitosis, de la misma manera que la cloroquina, al tiempo que determina la disminución en la producción de citocinas implicadas en la respuesta inflamatoria, IL-1, IL-2, IL-6, IL-17, IL-22.22 El mecanismo de acción quizá más importante se relaciona con la inhibición de la activación de algunos TLR, específicamente los intracelulares que reconocen ácidos nucleicos (TLR 3, 7, 8 y 9).21 Estos receptores participan en la inmunidad innata y tienen un papel clave en las EAS. La hidroxicloroquina tiene mayor seguridad clínica y permite indicar dosis mayores que la cloroquina per se. Los efectos adversos más frecuentes son leves, incluidas las molestias gastrointestinales, prurito y pigmentación cutánea. Las complicaciones cardiacas son excepcionales22 y su prescripción es segura en mujeres embarazadas y durante la lactancia.23
La azitromicina es un macrólido que inhibe la síntesis de proteínas en bacterias al unirse a la subunidad 50S ribosomal. No se ha descrito su efecto en los ribosomas de células eucariotas, y es sumamente prescrita para tratar a pacientes con infecciones respiratorias. Tiene propiedades inmunomoduladoras24 porque actúa como supresor de la activación de células TCD4+. En múltiples ensayos clínicos se han descrito los efectos terapéuticos de la azitromicina en procesos autoinflamatorios y enfermedades autoinmunitarias25-28 que no pueden explicarse por su actividad antibacteriana. Incluso, se ha indicado como inmunomodulador en el tratamiento de sepsis.28 La azitromicina ha demostrado inhibición in vitro de virus como Zika29 y Ébola.
En contraste con otros macrólidos, la azitromicina tiene la característica de no inhibir la oxidasa CYP3A4.1 Ha llamado la atención la combinación de hidroxicloroquina con azitromicina en un estudio efectuado en Francia,30 cuyo propósito original era disminuir el riesgo de sobreinfección bacteriana, tomando en cuenta, también, el efecto in vitro de la azitromicina contra Ébola y Zika, así como su efecto inmunomodulador para disminuir la gravedad de la enfermedad. En este estudio, se incluyeron 42 pacientes de los que 26 se trataron y 16 fueron controles. No se dio seguimiento a seis de los pacientes tratados porque 3 fueron internados en cuidados intensivos, uno abandonó el tratamiento por náusea y hubo una defunción. Se demostró la eficacia de la hidroxicloroquina en la disminución de la carga viral y en la eliminación nasofaríngea del virus en 70% de los portadores de SARS-CoV-2 en solo seis días vs 12.5% de pacientes positivos en el grupo control. Cuando se comparó el desenlace de los pacientes tratados con hidroxicloroquina en conjunto con azitromicina, los desenlaces fueron significativamente diferentes: se demostró que 100% de los pacientes con este tratamiento estaban libres de carga viral. A uno de los pacientes que recibió solo hidroxicloroquina se le agregó azitromicina y demostró eliminación total del virus al siguiente día.30
En otro ensayo clínico31 se incluyeron 80 pacientes positivos para SARS-CoV-2, incluidos 4 asintomáticos, todos con factores de riesgo predisponentes a mayor severidad de COVID-19: hipertensión, diabetes y EPOC. El 80% de los pacientes fueron dados de alta del hospital después de un promedio de 4.6 días de tratamiento y de éstos, 93% se encontraron sin carga viral al día 8 postratamiento. De los pacientes que siguieron hospitalizados, uno falleció en la sala de urgencias, 3 necesitaron terapia intensiva, uno de ellos permanecía en estado crítico y los otros dos continuaban en el área de Infectología. Estos desenlaces son muy prometedores e invitan a continuar investigando al respecto.30,31
La teicoplanina es un antibiótico glucopéptido indicado habitualmente en pacientes con infecciones bacterianas grampositivas, sobre todo con infecciones por estafilococos. Además, se ha demostrado su eficacia contra varios virus: Ébola, influenza, flavivirus, virus de hepatitis C, VIH y otros coronavirus, como el MERS-CoV y SARS-CoV. Por lo anterior, se ha añadido a la lista de moléculas que podrían prescribirse como una alternativa terapéutica contra COVID-19.32 No está por demás apuntar lo controvertido de los desenlaces de los ensayos y de la decisión de indicarlos, pero, a la luz de las circunstancias, no dejan de ser un recurso terapéutico real. La última palabra en esto, y las demás opciones terapéuticas, la darán el tiempo y la experiencia.
Con base en la efectividad demostrada en varios estudios, se registró en 2016 una patente para el tratamiento de la infección causada por MERS-CoV.32,33 De acuerdo con Zhou y colaboradores, en la familia de coronavirus, la teicoplanina actúa en el primer estadio del ciclo de vida viral; el mecanismo que describen es que tiene como blanco inhibir la actividad enzimática de catepsina L, necesaria para la fusión de membranas entre el virus y la célula huésped. Esto origina que no se promueva un pH bajo, necesario para la proteína viral spike o espiga, junto con la acción proteolítica de la catepsina L en los endosomas tardíos, lo que en consecuencia evita la liberación de ARN viral genómico y la continuación del ciclo de replicación del virus.
Un estudio reciente de los mismos autores demostró que esta actividad se conservó en SARS-Cov-2 (la secuencia objetivo que sirve como sitio de escisión para la catepsina L se conserva entre la proteína spike del SARS-CoV).33,34 Hasta ahora, y en un único experimento, se determinó la concentración de teicoplanina requerida para inhibir 50% de los virus (IC50) in vitro que fue de 1.66 μM, que es mucho más baja que la concentración alcanzada en la sangre humana (8.78 μM para una dosis diaria de 400 mg). Inclusive, se menciona que este antibiótico puede ser acoplado a nanopartículas magnéticas que poseen gran capacidad de carga de fármacos, baja toxicidad celular y alta biocompatibilidad.35 Estos resultados preliminares deben confirmarse ahora, mediante un ensayo clínico con asignación al azar. Sin duda, debe tomarse en consideración para un posible tratamiento, para evitar la replicación viral.
Favipiravir36-39 se ha utilizado en estudios clínicos en China y Japón, basados en su eficacia contra Ébola y fue aprobado para el tratamiento contra influenza en febrero de 2020. Se trata de un inhibidor de la ARN polimerasa, dependiente de ARN, capaz de bloquear la replicación de ARN-virus al ser fosforibosilado,37 de esta forma se convierte en favipiravir-RTP; es un sustrato para ARN polimerasa viral que de esa manera inhibe su actividad. En un estudio que comparó su efectividad contra arbidol39 se concluyó que, en pacientes con enfermedad leve, hubo disminución significativa de la carga viral y mejoría en la evolución clínica, confirmada en estudios radiológicos incluso en 71% de los pacientes; sin embargo, no se ha observado que tenga el mismo efecto en pacientes graves.
Algunos estudios han revelado potencial eficacia de otros medicamentos en el tratamiento de pacientes infectados con COVID-19. Tal es el caso de darunavir,36 cuya inhibición in vitro del SARS-CoV-2 ha propiciado el inicio de su estudio en ensayos clínicos.
La melatonina, por su parte, se está estudiando en China como coadyuvante en el tratamiento;40 hasta hora ha demostrado eficacia antiviral41 aportada por su acción antiinflamatoria y antioxidante.42 En ensayos en ratones ha demostrado disminuir la carga viral y las manifestaciones clínicas de la encefalitis viral.43
De acuerdo con la FDA (Food and Drug Administration), en su comunicado del 24 de marzo de 2020: “Se está explorando, en investigación, un tratamiento para pacientes infectados por COVID-19 que implica el uso de plasma convaleciente recolectado de pacientes recuperados con COVID-19.” Es posible que el plasma convaleciente que contiene anticuerpos contra el SARS-CoV-2 pueda ser efectivo contra la infección.44 En Estados Unidos se están iniciando ensayos clínicos para el tratamiento de pacientes en estado crítico, con plasma de pacientes recuperados que resulten negativos a las pruebas para COVID-19. Esto, con base en que la respuesta humoral mediada por anticuerpos es decisiva para prevenir infecciones virales. Un subconjunto de estos anticuerpos, que reducen la infectividad viral al unirse a los epítopos de la superficie de las partículas virales y, por tanto, bloquean la entrada del virus a una célula infectada, se definen como anticuerpos neutralizantes (NAbs).45 Estos anticuerpos provocan actividades protectoras: evitan la unión del virión a sus receptores en las células objetivo, causando la agregación de partículas virales. Además, los virus se lisan a través de la región constante (C) de la opsonización mediada por anticuerpos o la activación del complemento. Asimismo, en China, se llevó a cabo un ensayo clínico en 5 pacientes con enfermedad respiratoria severa y con ventilación mecánica asistida, tratados con plasma de pacientes recuperados.46,47 El plasma donador contenía IgG e IgM contra SARS-CoV-2, todos los pacientes estaban recibiendo antiviral y metilprednisolona al mismo tiempo. La conclusión fue que: todos los pacientes tuvieron normalización de las cifras de temperatura y mejoría en la escala SOFA a partir del día 3. PAO2-FiO2 mejoró al día 12; la carga viral descendió al cabo de 12 días. La cantidad de anticuerpos anti SARS-CoV-2 aumentó (de un límite de 40-60 previo a la transfusión a 80-320 en el día 7). Cuatro pacientes se curaron del síndrome respiratorio agudo a los 12 días después de la transfusión, 3 se dieron de alta al día 20 después de la transfusión y 2 permanecían hospitalizados y estables al día 37 después de la transfusión.48 Debido a que la población en estudio era muy pequeña, se requiere más investigación en este sentido.
CONCLUSIONES
Hasta ahora, aún no se dispone de un tratamiento antiviral específico ni de una vacuna; sin embargo, los investigadores de todo el mundo están explorando, sin descansar, los medicamentos que potencialmente podrían combatir a COVID-19. El tratamiento, por ahora, es sintomático en el que la terapia con O2 representa la principal intervención terapéutica para pacientes con infección severa. La ventilación mecánica es necesaria si persiste la insuficiencia respiratoria resistente al O2 así como soporte hemodinámico para tratar el choque séptico. La utilización de los agentes antivirales existentes es una estrategia potencialmente importante para tratar, a corto plazo, COVID-19. Sin embargo, la magnitud de la pandemia ha apurado la urgente necesidad de renovar esfuerzos para desarrollar agentes antivirales de amplio espectro. En tanto no se cuente con un tratamiento antiviral eficaz y con base en la eficacia de previas experiencias con profilaxis postexposición con antimicrobianos o antivirales49 en la prevención de la enfermedad y en la reducción del riesgo de propagación de la infección, se recomienda la indicación temprana de profilaxis con hidroxicloroquina, tan rápido como sea posible al personal sanitario postexposición. También se sugiere valorar, individualmente, el tratamiento conjunto con azitromicina, con base en su efecto sinérgico. Valorar su prescripción como tratamiento empírico en pacientes probables, con síntomas evidentes o en pacientes positivos, con enfermedad leve, además del tratamiento sintomático. En pacientes positivos con enfermedad severa, el inicio del tratamiento temprano con 400 mg de hidroxicloroquina por vía oral en la primera dosis y 200 mg misma vía cada 8 h durante 5 días y 500 mg de azitromicina al día durante 3 días. Además del tratamiento de soporte cardiovascular, se sugiere valorar la indicación de melatonina y tocilizumab para disminuir los síntomas clínicos y el deterioro de los pacientes con COVID-19 severo. El plasma convaleciente puede indicarse de manera rutinaria a pacientes críticamente infectados con COVID-19.
REFERENCIAS
1. Wrapp D, Wang N, Corbett KS, Goldsmith JA, Hsieh CL, Abiona O, Graham BS, McLellan JS. Cryo-EM structure of the 2019-nCoV Spike in the prefusion conformation. Science 2020, eabb2507.
2. Zhou F, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020 Mar 11. Pii: S0140-6736(20)30566-3. doi: 10.1016/S0140-6736(20)30566-3.
3. Marco Cascella, Micael Rajnik, Arturo Cuomo, Raffaela Di Napoli Features, Evaluation and Treatment Coronavirus (COVID-19). In: StatPearls . Treasure Island (FL): StatPearls Publishing; 2020 Jan- 2020 Mar 8.
4. Wu Z, McGoogan JM. Characteristics of and important lessons from the Coronavirus disease 2019 (COVID-19) outbreak in China: Summary of a report of 72,314 cases from the Chinese Center for Disease Control and Prevention. JAMA 2020 Feb 24. DOI: 10.1001/jama.2020.2648.
5. Du L, He Y, Zhou Y, Liu S, Zheng BJ, Jiang S. The spike protein of SARS-CoV – A target for vaccine and therapeutic development. Nat Rev Microbiol 2009;7(3):226-236. DOI: 10.1038/nrmicro2090.
6. Hoffmann M, Kleine-Weber H, Schroeder S, Kruger N, Herrler T, Erichsen S, Schiergens TS, Herrler G, Wu NH, Nitsche A, Muller MA, Drosten C, Pohlmann S. SARS-CoV-2 cell entry fepends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell 2020. DOI: 10.1016/j.cell.2020.02.052.
7. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, Zhang L, Fan G, Xu J, Gu X, Cheng Z, Yu T, Xia J, Wei Y, Wu W, Xie X, Yin W, Li H, Liu M, Xiao Y, Gao H, Guo L, Xie J, Wang G, Jiang R, Gao Z, Jin Q, Wang J, Cao B. Clinical features of patients infected with 2019 novel coronavirus in Wuhan. Lancet 2020;395:497-506. https://doi.org/10.1016/S0140-6736(20)30183-5.
8. Liu Cynthia, Li Yingzhu, Lin, et al. Research and development on therapeutic agents and vaccines for COVID-19 and related human Coronavirus diseases. ACS Cent Scl March, 2020. https://doi.org/10.1016/S0140-6736(20)30183-5.
9. Agostini ML, Andres EL, Sims AC, et al. Coronavirus susceptibility to the antiviral remdesivir (GS-5734) is mediated by the viral polymerase and the proofreading exoribonuclease. mBio DOI: 10.1128/mBio.00221-18.
10. Wang M, Cao R, Zhang L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Research 2020;30:269-271. https://doi.org/10.1038/s41422-020-0282-0.
11. Sheahan TP, Sims AC, Leist SR, et al. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV. Nat Comm 2020;11:222-222. DOI: 10.1038/s41467-019-13940-6.
12. Cao B, Wang Y, Wen D, et al. A trial of lopinavir-ritonavir in adults hospitalized with severe Covid-19. N Engl J Med. DOI: 10.1056/NEJMoa2001282.
13. Li Y, Chen M, Cao H, Zhu Y, Zheng J, Zhou H. Extraordinary GU-rich single-strand ARN identified from SARS coronavirus contributes an excessive innate immune response. Microbes Infect 2013;15:88-95. DOI: 10.1016/j.micinf.2012.10.008.
14. Xiaoling Xu, Mingfeng Han, Tiantian Li, et al. Effective treatment of severe COVID-19 patients with tocilizumab. ChinaXiv:202003.00026v1.
15. Coleman CM, Sisk JM, Mingo RM, Nelson EA, White JM, Frieman MB. Abelson kinase inhibitors are potent inhibitors of severe acute respiratory syndrome coronavirus and Middle East respiratory syndrome coronavirus fusion. J Virol 2016;90:8924-8933. DOI: 10.1128/JVI.01429-16.
16. Richardson P, Griffin I, Tucker C, Smith D, Oechsle O, Phelan A, Stebbing J. Baricitinib as potential treatment for 2019- nCoV acute respiratory disease. Lancet 2020;395(10223):e30-e31. DOI:https://doi.org/10.1016/S0140-6736(20)30304-4.
17. Savarino A, Di Trani L, Donatelli I, Cauda R, Cassone A. New insights into the antiviral effects of chloroquine. Lancet February 2006;6:67-96. DOI: 10.1016/S1473-3099(06)70361-9.
18. Yiwu Yan, Zhen Zou, Yang Sun, et al. Anti-malaria drug chloroquine is highly effective in treating avian influenza A H5N1 virus infection in an animal model. Cell Research 2013;23:300-302. DOI: 10.1038/cr.2012.165.
19. Colson P, Rolain JM, Raoult D. Chloroquine for the 2019 novel coronavirus SARS-CoV2. Int J Antimicrob Agents 2020 Feb 15:105923. doi: 10.1016/j.ijantimicag.2020.105923.
20. Gao J, Tian Z, Yang X. Breakthrough: chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. Biosci Trends 2020 Feb 19. DOI: 10.5582/bst.2020.01047.
21. Danza A, Graña D, Goñi M, Vargas A, Ruiz-Irastorza G. Hidroxicloroquina en el tratamiento de las enfermedades autoinmunes sistémicas. Rev Med Chile 2016;144:232-240. http://dx.doi.org/10.4067/S0034-98872016000200012.
22. Yao X, Ye F, Zhang M, et al. In vitro antiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). Clin Infect Dis 2020; (published online March 9) https://doi.org/10.1093/cid/ciaa237.
23. Danza A, Díaz L, Ruiz-Irastorza G. Hidroxicloroquina en el embarazo y la lactancia. Rev Med Urug 2015;31(2):128-32.
24. Zarogoulidis P, et al. Macrolides: from in vitro anti-inflammatory and immunomodulatory properties to clinical practice in respiratory diseases. Eur J Clin Pharmacol 2012;68:479-503. DOI: 10.1007/s00228-011-1161-x.
25. Balloy V, et al. Azithromycin analogue CSY0073 attenuates lung inflammation induced by LPS challenge. Br J Pharmacol 2014;171:1783-1794. DOI: 10.1111/bph.12574.
26. Wolter J, et al. Effect of long-term treatment with azithromycin on disease parameters in cystic fibrosis: a randomised trial. Thorax 2002;57:212-216. DOI: 10.1136/thorax.57.3.212.
27. Schultz MJ. Macrolide activities beyond their antimicrobial effects: macrolides in diffuse panbronchiolitis and cystic fibrosis. J Antimicrob Chemother 2004;54:21-28. DOI: 10.1093/jac/dkh309.
28. Wong C, et al. Azithromycin for prevention of exacerbations in non-cystic fibrosis bronchiectasis (EMBRACE): a randomised, double-blind, placebo-controlled trial. Lancet 2012;380:660-667. DOI: 10.1016/S0140-6736(12)60953-2.
29. Bosseboeuf E, Aubry M, Nhan T, de Pina, JJ, Rolain JM, Raoult D, et al. Azithromycin inhibits the replication of Zika virus. J Antivirals Antiretrovirals 2018;10(1):6-11. doi: 10.4172/1948-5964.1000173.
30. Gautret, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open label non-randomized clinical trial. Int J Antimicrob Agents. March 17 2020. DOI:10.1016/j.ijantimicag.2020.105949.
31. Gautret, et al. Clinical and microbiological effect of a combination of hydroxychloroquine and azithromycin in 80 COVID-19 patients with at least a six-day follow up: an observational study. Preprint.
32. Baron SA, Devaux C, Rolain JM, Raoult D, Colson P. Teicoplanin: an alternative drug for the treatment of coronavirus COVID-19?. Int J Antimicrob Agents 2020. DOI: 10.1016/j.ijantimicag.2020.105944.
33. Guangdi Li, Erik De Clercq. Therapeutic options for the 2019 novel coronavirus (2019-nCoV). Nature Reviews Drug Discovery 2020;19:149-150.
34. Zhang J, Ma X, Yu F, Liu J, Zou F, Pan T, et al. Teicoplanin potently blocks the cell entry of 2019-nCoV. BioRxiv 2020:2020.02.05.935387.
35. Armenia I, Marcone GL, Berini F, Orlandi VT, Pirrone C, Martegani E, Gornati R, Bernardini G, Marinelli F. Magnetic nanoconjugated teicoplanin: A novel tool for bacterial infection site targeting. Front Microbiol 2018;9:2270. doi: 10.3389/fmicb.2018.02270.
36. Dong L, Hu S, Gao J. Discovering drugs to treat coronavirus disease 2019 (COVID-19). Drug discoveries & therapeutics 2020;14(1):58-60. doi: 10.5582/ddt.2020.01012.
37. Delang L, Abdelnabi R, Neyts J. Favipiravir as a potential countermeasure against neglected and emerging ARN viruses. Antiviral Res 2018;153:85-94. DOI: 10.1016/j.antiviral.2018.03.003.
38. Furuta Y, Komeno T, Nakamura T. Favipiravir (T-705), a broad-spectrum inhibitor of viral ARN polymerase. Proc Jpn Acad Ser B Phys Biol Sci 2017;93:449-463. DOI: 10.2183/pjab.93.027.
39. Chang Chen, Jianying Huang, Zhenshun Cheng, Jianyuan Wu, et al. Favipiravir versus Arbidol for COVID-19: a randomized clinical trial. https://doi.org/10.1101/2020.03.17.20037432.
40. Zhang R, Wang X, Ni L, et al. COVID19: Melatonin as a potential adjuvant treatment. LifeSciences 2018. https://doi.org/10.1016/j.lfs.2020.117583.
41. Reiter RJ, Ma Q, Sharma T. Treatment of Ebola and other infectious diseases: melatonin “goes viral”. Melatonin Res 2020;3:43-57. DOI: 10.32794/mr11250047.
42. Boga JA, Coto-Montes A, Rosales-Corral SA, Tan DX, Reiter RJ. Beneficial actions of melatonin in the management of viral infections: a new use for this “molecular handyman”? Rev Med Virol 2012;22:323-338. DOI: 10.1002/rmv.1714.
43. Ben-Nathan D, Maestroni GJ, Lustig S, Conti A. Protective effects of melatonin in mice infected with encephalitis viruses. Arch Virol 1995;140:223-230. DOI: 10.1007/bf01309858.
44. FDA Website: https://www.fda.gov/vaccines-blood-biologics/ Investigational-new-drug-ind-ordevice-exemption-ide-process-cber/investigational-covid-19-convalescent-plasmaemergency-inds?utm_campaign=What%27sNew2020-03-24&utm_medium=email&utm_source=Eloqua.
45. Guangyu Zhou, Qi Zhao. Perspectives on therapeutic neutralizing antibodies against the Novel Coronavirus SARS-CoV-2. Int J Biol Sci 2020;16. DOI: 10.7150/ijbs.45123.
46. Shen C, Wang Z, Zhao F, et al. Treatment of 5 critically ill patients with COVID-19 with convalescent plasma. JAMA March 27, 2020. doi:10.1001/jama.2020.4783.
47. Casadevall A, Pirofski LA. The convalescent sera option for containing COVID-19. J Clin Invest 2020;138003. DOI: 10.1172/JCI138003.
48. Cheng Y, Wong R, Soo YO, et al. Use of convalescent plasma therapy in SARS patients in Hong Kong. Eur J Clin Microbiol Infect Dis 2005;24:44-46. DOI: 10.1007/s10096-004-1271-9.
49. Welliver R, Monto AS, Carewicz O, et al. Effectiveness of oseltamivir in preventing influenza in household contacts: a randomized controlled trial. JAMA 2001;285:748-754. DOI: 10.1001/jama.285.6.748.
[…] AD Sánchez Cadena, M Negreira Caamaño… – …, 2020 – revistanefrologia.com … La revista acepta artículos escritos en español o en inglés … b Servicio de Cardiología, Hospital General Universitario de Ciudad Real, Ciudad Real, España. c Servicio de Medicina Interna, Hospital General Universitario de Ciudad Real, Ciudad Real … Este artículo ha recibido … Artículos relacionados Las 2 versiones [HTML] medicinainterna.org.mx […]