Síndrome posresección transuretral de próstata
Med Int Méx 2024; 40 (8): 516-524. https://doi.org/10.24245/mim.v40iSeptiembre.8946
Guillermo Murillo Godínez
Medicina Interna, Querétaro, Qro., México.
“Cuando los cabellos se vuelven grises y escasos;
cuando los depósitos ateromatosos invaden las túnicas arteriales;
cuando se forma una sombra blanca alrededor de la córnea,
entonces es cuando la próstata aumenta su volumen.”
Brodie (citado en: Woolrich DJ, 1980)
INTRODUCCIÓN
Las primeras prostatectomías fueron efectuadas por Ambrosio Paré (1510-1590) y por Nicola Massa (1563), quienes de esta manera curaban el llamado “mal de orina” ocasionado por “carnosidades” (Woolrich DJ, 1980). McCarthi, en 1932, introdujo el resectoscopio provisto de un sistema óptico de visión oblicua, asa de resección y electrocauterio. En 1970, Iglesias, introdujo el resectoscopio de flujo continuo (irrigación-aspiración) (Bella RA, 2002). En Estados Unidos, en 1998, se practicaron 200,000 prostatectomías (Collins MA, 2021) y en 1985 la prostatectomía correspondió al 38% de las cirugías mayores en el campo de la Urología (Roehrborn CG, 2021).
En 1990 la tasa de frecuencia relativa de resección transuretral de próstata en pacientes quirúrgicos con hiperplasia-hipertrofia prostática obstructivaa, en Estados Unidos, fue del 97%, con tasas similares en Dinamarca y Suecia. Las tasas más bajas de resección transuretral de próstata se observaron en Japón (70%) y en Francia (69%) (Collins MA, 2021). En Estados Unidos, cerca del 70% de los sujetos entre 60 y 69 años y el 80% de los de 70 o más tienen algún grado de hiperplasia-hipertrofia prostática obstructiva (McVary KT, 2021). Se espera que la cantidad de hombres mayores con síntomas relacionados con la hiperplasia-hipertrofia prostática obstructiva en Estados Unidos aumente a 9 millones para 2025 (Collins MA, 2021). En México, la primera resección transuretral de próstata fue practicada en el servicio de Urología (Pabellón 5) del Hospital General de México por Aquilino Villanueva y Manuel Lezama el 15 de diciembre de 1933, en un caso de hiperplasia-hipertrofia prostática obstructiva (Villanueva A, 1986).
El síndrome posresección transuretral de próstata fue descrito inicialmente por Creevy y Webb en 1947 y lo asociaron con hemólisis al usar agua como solución irrigadora (Creevy CD, 1947; Forero MJA, 1999); en su momento sugirieron usar mejor solución glucosada al 4%. Harrison y colaboradores, en 1956, atribuyeron la causa del síndrome a la hiponatremia dilucional resultante (Harrison RH, 1956). Es una complicación que puede ocurrir en el 1-20% de los casos (Bedós F, 1989; Kim HL, 2006; Olivares MH, 1994; Olumi AF, 2009; Sánchez LHM; Taneja SS, 2010), con una mortalidad del 0.2 al 2.5% (Forero MJA, 1999; García IC, 2001; Olivares MH, 1994; Suaza-Martínez LR, 2019; Taneja SS, 2010).
Los criterios para llevar a cabo la cirugía de resección transuretral de próstata ahora son más estrictos que antes. En general, la resección transuretral de próstata se reserva para pacientes con hiperplasia-hipertrofia prostática obstructiva sintomática que tienen retención urinaria aguda, recurrente o crónica; en quienes el manejo médico y los procedimientos quirúrgicos prostáticos menos invasivos fallaron; que tienen próstatas de tamaño o forma inusual (por ejemplo, un lóbulo medio marcadamente agrandado, invasión prostática intravesical significativa); que tienen azotemia o insuficiencia renal debida a obstrucción prostática, o que tienen los síntomas más severos de prostatismo. Las indicaciones menos comunes de la resección transuretral de próstata incluyen la prostatitis intratable o para la toma de muestras de tejido cuando no puede recurrirse a las técnicas de biopsia estándar (Collins MA, 2021).
Soluciones irrigadoras
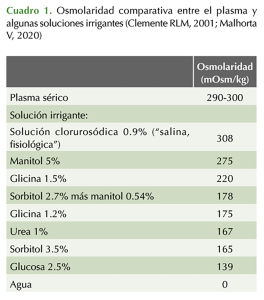
Idealmente la solución de irrigación para su uso durante la resección transuretral de próstata debe ser: isotónica, no hemolítica, eléctricamente inerte, transparente, no metabolizable, no tóxica, excretada rápidamente, esterilizada fácilmente, económica y, en caso de ser absorbida, su metabolismo no debe producir sustancias tóxicas, fácil de usar, apirógena, no alergénica; tal solución aún no existe (Clemente RLM, 2001; Malhotra V, 2020; Sánchez-Rubio F, 2008; Vargas HVM, 2005).
Durante la resección transuretral de próstata históricamente se han utilizado diversas soluciones para irrigación que reúnen algunas de las características deseables, por ejemplo:
• Agua bidestilada: es eléctricamente inerte, transparente y barata, pero es hipotónica (Bedós F, 1989; Malhotra V, 2020).
• Manitol al 5%: es una solución ligeramente hipotónica, rápidamente excretada, que puede causar rápida expansión del volumen intravascular, lo que permite que el líquido extravasado sea absorbido más fácilmente y esto favorece la hiponatremia dilucional (Taneja SS, 2010).
• Sorbitol al 3.5%: es una solución de D-glicitol que es una forma reducida de la dextrosa; es metabolizado a CO2 y agua y puede ocasionar hiperglucemia (Taneja SS, 2010).
• Glicinab al 1.5%c: fue introducida por Nesbit y Glickman en 1948 para este fin (Bedós, F, 1989); es un líquido no hemolítico, hipotónico (Taneja SS, 2010), de transparencia imperfecta (Bedós F, 1989); la glicina experimenta desaminación oxidativa en el hígado y los riñones, formándose amonio y ácido glicólicod (Forero MJA, 1999; Olumi, AF, 2009; Vargas HVM, 2005). El amonio causa mialgias, alteraciones visuales (Vargas HVM, 2005) y encefalopatía a concentraciones séricas mayores de 150 mMol/L (Forero MJA, 1999; Sterns RH, 2005), por lo que no debe darse a hepatópatas (Taneja SS, 2010). La asociación entre la absorción de glicina y la hiperamonemia fue propuesta inicialmente por Hoyrt en 1958 (Forero MJA, 1999).
• Solución glucosada al 4%: no es hemolítica ni hipotónica (Bedós F, 1989), pero puede ocasionar hiperglucemia.
También se han administrado soluciones de: sorbitol 2.7% más manitol 0.54% (Cytal)e, urea 1%, glicina 1.2 y 2.2%, glucosa 2.5% y manitol 3% (Clemente RLM, 2001; Muñoz RJA, 1997; Olivares MH, 1994). Asimismo, se ha administrado la llamada solución hipertónica-hiperoncótica, que contiene: dextran 60 (6 g) más NaCl 7.5 g, 1280 mEq/L más agua inyectable en presentación de 250 mL, con la que no se ha visto afectación del sodio y de la presión oncótica durante el procedimiento de resección transuretral de próstata (de los Santos MDA, 2000). Cuando se dispone sólo de electrorresectores unipolares, las soluciones comúnmente administradas son las de glicina, sorbitol o manitol con el riesgo de aparición del síndrome posresección transuretral de próstata (Lerner LB, 2021).
• La osmolaridad comparativa entre algunas soluciones irrigantes y el plasma se muestra en el Cuadro 1.
• Solución salina 0.9%: es isotónica, pero los electrolitos presentes en esta solución, al igual que en la de Ringer lactato (Hartmann), disipan la corriente eléctrica si se usan resectores monopolares (Kim HL, 2006), lo que disminuye la eficacia del corte (Bedós F, 1989; Welliver C, 2016).
En la actualidad la solución salina 0.9% es la administrada habitualmente utilizando sistemas de electrorresección con un electrodo bipolar (Collins MA, 2021; Lerner LB, 2021: Taylor MJ, 2022; Valdivia UJG, 2005), ya que parte fundamental en la física del funcionamiento de estos dispositivos es que el arco eléctrico debe trasladarse de un sitio a otro a través de los elementos disueltos en la solución (Vargas HVM, 2005). El uso de esta solución incluye los procedimientos en los que se utilizan láseres: Ho:YAGf (Shabsigh, 2019) amortiguado (dopado) con Nd:YAGg, el KTPh green light y otros láseres (láser de triborato de litio, láser de tulio, láser de diodo) (Woo HH, 2011; Zhang J, 2019; Zhu Y, 2015).
Con la administración de solución isotónica se considera que el síndrome posresección transuretral de próstata es casi solo histórico, aunque aún se produce la absorción de un volumen significativo de líquido con la resección prolongada. El objetivo de los procedimientos con láser, en cualquier caso, es producir un efecto en la próstata comparable al que se esperaría después de una resección transuretral de próstata estándar, pero con menor hemorragia y riesgo de perforación. Las posibles desventajas son: síntomas irritativos con la micción más intensos en el corto plazo después del procedimiento y menor durabilidad del resultado en el largo plazo respecto de la resección transuretral de próstata habitual. La tasa de riesgo a 5 años de una reoperación después de la resección transuretral de próstata es de aproximadamente el 5% (Collins MA, 2021). Puesto que se destruye tejido en lugar de resecarlo, no se envía espécimen para estudio histopatológico (Washington, 2020).
Factores de riesgo
El riesgo de aparición del síndrome es mayor cuando la glándula prostática pesa más de 45 g, cuando la duración de la intervención es superior a 60-90 minutos (con extremos de 15-150 minutos) (Olivares MH, 1994), cuando el líquido de irrigación se sitúa a más de 60-100 cm de agua por encima del paciente, por incremento de la presión hidrostática, o cuando se usa una presión del líquido irrigante mayor a 10 mmHg (Bedós F, 1989; Forero MJA, 1999; Olumi, AF, 2009; Taneja SS, 2010), por lo que para reducir la posibilidad de que sobrevenga el síndrome, se recomienda llevar a cabo el procedimiento con baja presión hidráulica (Verger-Kuhnke AB, 2006).
Los grados de riesgo de aparición del síndrome posresección transuretral de próstata, de acuerdo con la clasificación de Singh, son (Forero MJA, 1999):
Grado 1: ≤ 70 años, sin problemas médicos asociados.
Grado 2: 71-80 años, con comorbilidades (diabetes mellitus, hipertensión arterial enfermedad pulmonar obstructiva crónica, isquemia coronaria, insuficiencia renal).
Grado 3: > 80 años, con infarto de miocardio de menos de 6 meses de evolución, o insuficiencia renal crónica avanzada.
Fisiopatología
Cuando se usa solución irrigante durante la resección transuretral de próstata ésta puede ser absorbida sistémicamente, a través de los canales venosos de la próstata (Forero MJA, 1999; Kim HL, 2006), en cifras de 300 a 8000 ml (López AG, 1985), a una tasa de 10-190 mL/min (Bedós F, 1989; Forero MJA, 1999), o puede haber absorción de líquido extravasado después de una perforación inadvertida de la cápsula prostática. Esta perforación se manifiesta por una abundante hemorragia negra (Bedós F, 1989; Forero MJA, 1999), o puede haber perforación de la pared vesical (Taneja SS, 2010). Hay reducción del sodio sérico: como regla general, la concentración de sodio puede bajar 10 mMol/L por cada 1000 mL de solución absorbida (Vargas HVM, 2005). La hiponatremia dilucional puede ser la única causante de los síntomas o estar implicada la hiperamonemia, o ser resultado del efecto tóxico directo de la glicinai, porque ésta, por sí sola, tiene efectos neuroinhibitorios y puede causar hipotensión arterial y bradicardia, además de ceguera transitoria, y aumento de la liberación de péptido natriurético auricular (Criado CG, 2023; Sterns RH, 2005). Además, esto se ve favorecido por la diuresis osmótica asociada con los fluidos de irrigación.
Cuadro clínico y paraclínico
El síndrome posresección transuretral de próstata puede manifestarse con: confusión mental, náuseas, vómitos, hipertensión arterial, bradicardia, alteraciones visuales, taquipnea y necrosis tubular aguda, que pueden evolucionar a coma, taquicardia, fibrilación ventricular y paro cardiaco (Kim HL, 2006; Forero MJA, 1999; Olumi, AF, 2009). Predominan la hipertensión arterial y la confusión mental, algunos síntomas pueden enmascararse si el paciente tiene anestesia general (Collins MA, 2021; McGowan-Smyth S, 2016) o pueden atribuirse a otras causas, como: accidente cerebrovascular, infarto de miocardio, embolia pulmonar, estado de choque séptico o síndrome de transfusión de sangre incompatible, si se desconoce la existencia del síndrome (Bedós F, 1989).
Por lo general, el paciente no experimenta síntomas hasta que la hiponatremia desciende a 125 mEq/L, por lo que algunos toman esta cifra, aunada a las manifestaciones cardiovasculares y neurológicas, como definitorias del síndrome (Syed FM, 2016); cuando la hiponatremia es de 120 mEq/L hay hipotensión arterial, hipocontractilidad cardiaca, inquietud y confusión mental (Forero MJA, 1999; Olumi, AF, 2009; Taneja SS, 2010). Al llegar a 115 mEq/L aparecen cambios electrocardiográficos: ampliación del complejo QRS, bradicardia, elevación del segmento ST y extrasistolia (Forero MJA, 1999), y convulsiones. Cuando la hiponatremia es de 100 mEq/L, además de la hiponatremia, que se considera la alteración esencial, hay disminución del hematocrito por hemodilución y disminución de la osmolaridad plasmática (Bedós F, 1989); también se ha documentado hipocalcemia (Forero MJA, 1999).
Puede haber una manifestación menos abrupta del cuadro clínico en la que la absorción del líquido es más lenta, consecutiva a una extravasación perivesical, periprostática e, incluso, intraperitoneal; las manifestaciones ocurren en el curso de los primeros cuatro días, a lo que se le denomina síndrome diferido o de inicio tardío (Bedós F, 1989; Sterns RH, 2005).
Los signos y síntomas del síndrome posresección transuretral de próstata y sus causas pueden agruparse como se muestra en el Cuadro 2 (Holt NF, 2023).

Tratamiento
Para tratar el síndrome posresección transuretral de próstata puede administrarse: furosemida IV, infusión de solución salina hipertónica, preconizada por Drinker, en situaciones con riesgo vital (Castro AD, 1997), al 3 o 5% (Bedós F, 1989; Forero MJA, 1999), que corrige la hiponatremia en 8-24 horas (Bedós F, 1989; Olumi AF, 2009), con aumento del sodio de 4-6 mEq/L en las primeras 4-6 horas porque la corrección más rápida puede ocasionar el llamado síndrome de desmielinización osmótica o mielinolisis pontina, sobre todo en pacientes alcohólicos y desnutridos (Barajas GDE, 2023; Castro AD, 1997; Muñoz RJA, 1997); administración IV u oral de L-arginina para tratar la hiperamonemia (Forero MJA, 1999); midazolam IV si hay crisis convulsivas, antagonistas de la vasopresina, por su efecto diurético, y ventilación mecánica si hay edema pulmonar. También se ha indicado la terapia de reemplazo renal continua (Dongqin DBS, 2022) y la hemodiálisis (Agarwal R, 1994).
Se han comunicado casos de pancreatitis posresección transuretral de próstata que se atribuyen a la estimulación exocrina del páncreas, en caso de haber administrado furosemida, o a que el fármaco podría dañar la perfusión pancreática por la diuresis y disminuir el volumen intravascular, afectando el flujo sanguíneo, lo que puede conducir a isquemia o a hipersensibilidad de una respuesta inmunológica (Berber-Deseusa A, 2014).
Profilaxis
Para prevenir el síndrome posresección transuretral de próstata deben controlarse, en lo posible, los factores de riesgo mencionados. Si es factible, debe vigilarse estrechamente la presión venosa central (Bedós F, 1989) y llevar un registro meticuloso de ingresos-egresos de líquidos (Vargas HVM, 2005). La administración de vasopresina se ha asociado con el decremento de la intravasación de fluido por su efecto vasoconstrictor (Vargas HVM, 2005).
Se menciona que es útil la vigilancia de la concentración de etanol en aire espirado porque permite de manera muy fidedigna valorar la cantidad de infusión absorbida, se estima que concentraciones de 0.2 mg/mL se asocian con importantes volúmenes absorbidos y con morbilidad (Moncada GJP, 2009); también debe vigilarse el sodio sérico (Vargas HVM, 2005).
Epílogo
Las complicaciones perioperatorias se dividen, según la clasificación de Clavien-Dindo, en siete grados: I, II, IIIa, IIIb, IVa, IVb y V (Clavien PA, 1992; Dindo D, 2004) (Cuadro 3); éstas pueden ser válidas en varias intervenciones urológicas (Caravia PI, 2015) y, en particular, en la resección transuretral de próstata (Suaza-Martínez LR, 2019).

La administración inhibidores de la 5-α-reductasa (finasterida, dutasterida, turosterida, y de fitofármacos como: Serenoa repens, Pygeun africanum, Echinacea purpurea, Hypoxis rooperi y, sin duda, el uso de resectores bipolares (Issa MM, 2008; Omar MI, 2014) que permiten efectuar la irrigación con soluciones isotónicas, han disminuido progresivamente la incidencia del síndrome posresección transuretral de próstata; sin embargo, la eficacia parcial de los medicamentos y el costo de este tipo de instrumentos, respectivamente, hacen que su disponibilidad, aún no sea generalizada, por lo que puede seguir ocurriendo la enfermedad, aunque en Estados Unidos se ha demostrado que el costo de la cirugía es menor que el de los tratamientos médicos en un lapso desde seis meses hasta ocho años (Sorensen M, 2022).
Con el advenimiento de nuevas técnicas de tratamiento, como la termoterapia con microondas (De La Rosette JJ, 2003; Floratos DL, 2001) y otras (vaporización en plasma salino, vaporización bipolar “tipo botón”, Acuaablación®, embolización arterial) (Geavlete B, 2010; Gilling P, 2017; Jung JH, 2020; Wroclawski ML, 2016), disminuirá aún más la incidencia del síndrome posresección transuretral de próstata.
El síndrome posresección transuretral de próstata no es exclusivo de este procedimiento, puede ocurrir en otros actos quirúrgicos que también utilicen grandes volúmenes de soluciones irrigadoras (Taneja SS, 2010): resección transuretral de tumores vesicales, procedimientos diagnósticos y terapéuticos transcervicales histeroscópicos (por ejemplo, resección de leiomiomas submucosos) (Vargas HVM, 2005) y la extirpación percutánea de cálculos renales (Emmett, 2022). Debido a que el síndrome posresección transuretral de próstata también puede ocurrir en otros procedimientos, algunos lo llaman: síndrome de hipervolemia hiponatrémica (Vargas HVM, 2005) o síndrome de hemodilución e hiponatremia (García IC, 2001).
BIBLIOGRAFÍA
1. Agarwal R, Emmett M. The post-transurethral resection of prostate syndrome: Therapeutic proposals. Am J Kidney Dis 1994; 24 (1): 108-111. doi: 10.1016/s0272-6386(12)80169-7
2. Barajas GDE, Ruiz-Sánchez JG, Fernández MA, Runkle de la V I, et al. Consensus document on the management of hyponatraemia of the Acqua Group of the Spanish Society of Endocrinology and Nutrition. Endocrinol Diabetes Nutr 2023; 70: 7-26. doi: 10.1016/j.endien.2022.11.006
3. Bedós F, Cibert J. Adenoma prostático, en: Urología. La terapéutica y sus bases. Barcelona: Espaxs. Publicaciones médicas, 1989: 997-1048.
4. Rando AB. Resección transuretral de próstata. Asoc Esp Enf Urol 2002; 84: 37-42.
5. Berber-Deseusa A, Rosas-Nava JE, de los Santos-González J. Pancreatitis posterior a resección transuretral de próstata. Rev Mex Urol 2014; 74 (3): 187-189.
6. Caravia PI, Vela CI. Aplicabilidad de la clasificación de Clavien y Dindo en las complicaciones quirúrgicas urológicas. Rev Cub Urol 2015; 4 (2): 83-88.
7. Carvajal-Sandoval G, Juárez de CE, Ramos-Martínez G, Carvajal JME. Inhibición de la glicosilación no enzimática de la hemoglobina en la diabetes mellitus. Rev Inst Nal Enf Resp (Mex) 1995; 8 (3) 185-188.
8. Castro AD. Management of anesthesia for specialty procedures. Transurethral resection of the prostate (TURP). In: Longnecker DE, Murphy FL. Dripps/Eckenhoff/Vandam. Introduction to Anesthesia. Philadelphia: WB Saunders Co. 1997: 420.
9. Clavien PA, Sanabria JR, Strasberg SM. Proposed classification of complications of surgery with examples of utility in cholecystectomy. Surgery 1992; 111 (5): 518-526.
10. Clemente RLM, Ramasco RF, Platas SA, et al. Síndrome de reabsorción post-resección transuretral (R.T.U.) de próstata: Revisión de aspectos fisiopatológicos, diagnósticos y terapéuticos. Actas Urol Esp 2001; 25 (1): 14-31.
11. Creevy CD, Webb EA. A fatal hemolytic reaction following thransuretral resection of the prostate gland. Surgery 1947; 21: 56-66.
12. Criado CG, Delfau LD, Patiño AA, et al. Síndrome de reabsorción post-resección transuretral (RTU). Portalesmedicos.com 2023; XVIII (4): 175.
13. Collins MA. Transurethral resection of the prostate. Medscape 2021.
14. De La Rosette JJ, Floratos DL, Severens JL, et al. Transurethral resection vs microwave thermotherapy of the prostate: a cost-consequences analysis. BJU Int 2003; 92: 713-718. doi: 10.1046/j.1464-410x.2003.04470.x
15. De los Santos MDA, Caballero de L FC, Gómez MJ de J. Solución hipertónica e hiperoncótica en pacientes sometidos a resección transuretral de próstata. Rev Mex Anest 2000; 23: 34-37.
16. Dindo D, Demartinez N, Clavien PA. Classification of surgical complications: A new proposal with evaluation in cohort of 6336 patients and results of a survey. Ann Surg 2004; 240: 205-213. doi: 10.1097/01.sla.0000133083.54934.ae
17. Deng D, Zhang Q, Tu W, et. al. Initiating continuous renal replacement therapy in patients with transurethral resection of prostate syndrome: A case report. J Perianesth Nurs 2023; 38 (3): 379-381. https://doi.org/10.1016/j.jopan.2022.09.001
18. Emmett M, Istre O, Hahn RG. Hyponatremia following transurethral resection, hysteroscopy, or other procedures involving electrolyte-free irrigation. UptoDate 2022.
19. Floratos DL, Kiemeney LA, Rossi C, et al. Long-term followup of randomized transurethral microwave thermotherapy versus transurethral prostatic resection study. J Urol 2001; 165: 1533-1538.
20. Forero MJA, Guzmán C. Síndrome de resección transuretral de próstata en el Hospital San Juan de Dios. Urol Colomb 1999; 8 (3): 35-52.
21. García IC. Hiperplasia prostática benigna obstructiva. En: Martín AL, editor. Compendio de Medicina General. México: Méndez Editores, 2001; VI: 35-40.
22. Geavlete B, Multescu R, Dragutescu M, et. al. Transurethral resection (TUR) in saline plasma vaporization of the prostate vs standard TUR of the prostate: ‘the better choice’ in benign prostatic hyperplasia? BJU Int 2010; 106 (11): 1695-1699. doi: 10.1111/j.1464-410X.2010.09433.x
23. Gilling P, Anderson P, Tan A. Aquablation of the prostate for symptomatic benign prostatic hyperplasia: 1-year results. J Urol 2017; 197 (6): 1565-1572. doi: 10.1016/j.juro.2017.01.056
24. Guillispie ST, Coburn M. Cirugía urológica. En: Townsend CM, Beauchamp RD, Evers BM, Mattox KL. Sabiston. Tratado de Cirugía. Fundamentos biológicos de la práctica quirúrgica moderna. Barcelona: Elsevier, 2018: 2078.
25. Harrison RH, Boren JS, Robinson Jr. Dilutional hyponatremic shock: another concept of the transurethral prostatic resection reaction J Urol 1956; 75: 95-109. doi: 10.1016/S0022-5347(17)66783-1
26. Holt NF, Hickey TR. Enfermedades renales, en: Hines RL, Jones SB. Stoelting. Tratado de anestesia y enfermedad coexistente. Barcelona: Elsevier, 2023; 3: 415-437.
27. Jung JH, McCutcheon KA, Borofsky M, et al. Prostatic arterial embolization for the treatment of lower urinary tract symptoms in men with benign prostatic hyperplasia. Cochrane Database Syst Rev 2020; 12: CD012867. doi: 10.1002/14651858.CD012867.pub2
28. Issa MM. Technological advances in transurethral resection of the prostate: bipolar versus monopolar TURP. J Endourol 2008; 22: 1587-1595. doi: 10.1089/end.2008.0192
29. Kim HL, Belldegrun A. Urología. En: Brunicardi FC, Andersen DK, Billiar DK, Dunn Dl, Hunter JG, Pollock RE. Schwartz. Principios de cirugía. México: McGraw-Hill Interamericana, 2006; II: 1530-1531.
30. Lerner LB, McVary KT, Barry MJ, et. al. Management of lower urinary tract symptoms attributed to benign prostatic hyperplasia: AUA Guideline. J Urol 2021; 206: 806-826.
31. López AG. Anestesia para especialidades quirúrgicas. Anestesia en Urología, en: Fundamentos de Anestesiología. La Prensa Médica Mexicana 1985: 467-468.
32. Malhotra V, Malhotra A, Pamnani A, Gainsburg D. Anesthesia and the renal and genitourinary systems. En: Gropper MA, editor. Miller’s Anesthesia. Philadelphia: Elsevier, 2020: 1942-1945.
33. McGowan-Smyth S, Vasdev N, Gowrie-Mohan S. Spinal anesthesia facilitates the early recognition of TUR syndrome. Curr Urol 2016; 9 (2): 57-61. doi: 10.1159/000442854
34. McVary KT. Surgical treatment of benign prostatic hyperplasia (BPH). UptoDate® 2021.
35. Moncada GJP, Donoso DW. Síndrome de resección transuretral de próstata. Revisión de conceptos. Rev Fac Med (Bogotá) 2009; 57 (2): 184-195.
36. Muñoz RJA, García PA. Síndrome subsecuente a resección transuretral de la próstata. Bol Col Mex Urol 1997; 14: 81-84.
37. Nuño LAE, Fraire MMI, Alatorre ME. Valoración electromiográfica del tratamiento con glicina a pacientes espásticos. Arch Neurocien Mex 1996; 1 (4): 279-282.
38. Olivares MH, Bermúdez OG, Lanza BE, Mesa PA, Alfaro VF, Luna OP. Síndrome de prostatectomía transuretral. Reporte de un caso. Rev Mex Anest 1994; 17 (2).
39. Olumi AF, Richie JP. Cirugía urológica. En: Townsend CM, Beauchamp RE, Evers BM, Mattox KL. Sabiston. Tratado de cirugía. Fundamentos biológicos de la práctica quirúrgica moderna. Barcelona Elsevier España, 2009: 2271-2272.
40. Omar MI, Lam TB, Alexander CE, et al. Systematic review and meta-analysis of the clinical effectiveness of bipolar compared with monopolar transurethral resection of the prostate (TURP). BJU Int 2014; 113: 24-35. doi: 10.1111/bju.12281
41. Roehrborn CG, Strand DW. Benign prostatic hyperplasia: Etiology, pathophysiology, epidemiology, and natural history. En: Partin AW, Dmochowski RR, Kavoussi LR, Peters CA. Campbell-Walsh-Wein. Philadelphia: Urology, 2021: 3329.
42. Sánchez LHM. Hiperplasia benigna de próstata. En: Manual práctico de urología. México: Sociedad Mexicana de Urología-Edit. Cuellar Ayala, 2014: 74-103.
43. Sánchez-Rubio FJ, Rubio CB, Ibáñez HN, Arteta JM. Síndrome de resección transuretral. Farm Hosp 2008; 32 (4): 253-255.
44. Schulte TL, Hammer HJ, Reynolds LR. Clinical use of Cytal in urology. J Urol 1954; 71 (5): 656-659. https://doi.org/10.1016/S0022-5347(17)67841-8
45. Shabsigh A, Sourial M, Bellows FF, et. al. Urology. En: Brunicardi FC. Schwartz’s Principles of Surgery. Nueva York: McGraw-Hill, 2019; 2: 1764.
46. Sorensen M, Walsh TJ, Haider MA. Hiperplasia prostática benigna. En: Papadakis MA, McPhee SJ, Rabow MW, McQuaid KR, eds. Diagnóstico clínico y tratamiento. Nueva York: McGraw-Hill, 2022:
47. Sterns RH. Disorders of water and sodium balance. En: Souba WW, Fink MP, Jurkovich GJ, Kaiser KR, Pearce WH, Pemberton JH, et al, editors. ACS Surgery Principles & Practice. Nueva York: WebMD, 2005: 1264-1265.
48. Suaza-Martínez LR, García-Valencia J, Giraldo-Arismendi AM. Factores de riesgo asociados a complicaciones perioperatorias en la resección transuretral de próstata con bipolar. Revisión narrativa de la literatura. Iatreia 2019; 32 (2): 102-112. https://doi.org/10.17533/udea.iatreia.06
49. Syed FM, Gordo FME, Gómez GI, Paz MD. Síndrome post resección transuretral. Rev Elect Anestesiar 2016; 8 (5): 1-6. https://doi.org/10.30445/rear.v8i5.104
50. Taneja SS. Metabolic complications of urologic surgery. Philadelphia: WB Saunders, 2010.
51. Taylor MJ, Smith TG, Coburn M. Cirugía urológica. En: Townsend CM, Beauchamp RD, Evers BM, Mattox KL, eds. Sabiston. Tratado de Cirugía. Fundamentos biológicos de la práctica quirúrgica moderna. Barcelona: Elsevier España, 2022: 2071-2072.
52. Valdivia UJG, Regojo ZO, Sánchez ZJM, et al. La resección transuretral con solución salina: un logro tecnológico aún no asimilado por la urología. Arch Esp Urol 2005; 58 (4): 335-345.
53. Vargas HVM, Histerectomía. Indicaciones, complicaciones, alternativas. México: Distribuidora y Editora Mexicana, 2005: passim.
54. Verger-Kuhnke AB, Reuter MA, Epple W, Ungemach G. La resección transuretral de la próstata de baja presión hidráulica, resultados en 340 pacientes con adenomas grandes. Actas Urol Esp 2006; 30 (9): 896-904.
55. Villanueva A. La cirugía endoscópica, en: Historia de la Medicina y desarrollo de la Urología en los países occidentales. México: Universidad Nacional Autónoma de México, 1986: 188.
56. Washington SL III, Shinohara K. Disorders of the bladder, prostate, and seminal vesicles. En: McAninch JW, Lue TF. Smith & Tanagho’s. General Urology. Nueva York: McGraw-Hill, 2020: 598.
57. Welliver C, McVary KT. Minimally invasive and endoscopic management of benign prostatic hyperplasia. En: Wein AJ, Kavoussi LR, Partin AW, Peters CA. Campbell-Walsh Urology. Philadelphia: Elsevier, 2016: 2504-2534.
58. Woo HH, Hossack TA. Photoselective vaporization of the prostate with the 120-W lithium triborate laser in men taking coumadin. Urology 2011; 78 (1): 142-145. doi: 10.1016/j.urology.2010.12.082
59. Woolrich DJ. Tumores de la próstata. En: Woolrich DJ. Urología e introducción a la sexología. México: Academia Nacional de Medicina, 1980: 383-407.
60. Wroclawski ML, Carneiro A, Dal Moro AR, et. al. ‘Button type’ bipolar plasma vaporisation of the prostate compared with standard transurethral resection: a systematic review and meta-analysis of short-term outcome studies. BJU Int 2016; 117 (4): 662-668. doi: 10.1111/bju.13255
61. Zhang J, Wang X, Zhang Y, et al. 1470 nm diode laser enucleation vs plasmakinetic resection of the prostate for benign prostatic hyperplasia: A randomized study. J Endourol 2019; 33 (3): 211-217. doi: 10.1089/end.2018.0499
62. Zhu Y, Zhuo J, Xu D, et al. Thulium laser versus standard transurethral resection of the prostate for benign prostatic obstruction: a systematic review and meta-analysis. World J Urol 2015; 33 (4): 509-515. doi: 10.1007/s00345-014-1410-6
_______________________________________________________
a Aunque es común encontrar la denominación de hiperplasia prostática benigna (HPB), la especificación de benignidad es redundante, debido a que está implícita en el término hiperplasia; la hiperplasia ocurre por aumento en la cantidad total de células estromales y epiteliales dentro de la zona de transición; como resultado de esta hiperplasia, pueden aparecer nódulos. La hipertrofia se debe al aumento en el tamaño de las células individuales que resulta en agrandamiento global de la glándula, sin nodularidad. A través de una combinación de estos dos procesos se produce el agrandamiento prostático que puede conducir a la obstrucción del cuello de la vejiga, lo que causa obstrucción (hiperplasia-hipertrofia prostática obstructiva) (McVary KT, 2021).
b También llamada ácido aminoacético o glicocola (Bedós F, 1989).
c Concentración 1000 veces superior a las concentraciones séricas.
d También llamado ácido glucolítico.
e La mezcla llamada Cytal, además del sorbitol y el manitol en las cantidades indicadas, también contiene: metilparahidroxibenzoato 5 mg, propilparahidroxibenzoato 1 mg y butilparahidroxibenzoato 1 mg (Schulte TL, 1954).
f Holmio: granate de itrio y aluminio.
g Neodimio: granate de itrio y aluminio.
h KTP: potasio-titanil-fosfato.
i Cabe señalar que, administrada por vía oral, carece de toxicidad a dosis hasta 20 g/24 horas y se ha administrado como espasmolítico esquelético (Nuño LAE, 1996) y como inhibidor de la glucosilación no enzimática de la hemoglobina (Carvajal-Sandoval G, 1995).
Recibido: 12 de junio 2023
Aceptado: 28 de junio 2023
Este artículo debe citarse como: Murillo-Godínez G. Síndrome posresección transuretral de próstata. Med Int Méx 2024; 40 (8): 516-524.
Sin comentarios