Homocisteína, otro factor de riesgo cardiovascular
Homocysteina, another cardiovascular risk factor.
Med Int Méx 2022; 38 (4): 903-913. https://doi.org/10.24245/mim.v38i4.6779
Guillermo Murillo-Godínez
Medicina Interna, Querétaro, Qro., México.
ANTECEDENTES
La hiperhomocisteinemia se ha considerado factor de riesgo independiente cardiovascular y neurológico; sin embargo, su corrección no ha derivado en disminución significativa de la incidencia de enfermedades en estos sistemas, por lo que se considera un tema aún en proceso de aclaración.
LA HOMOCISTEÍNA
La homocisteína (C4H9N1O2S1 o ácido 2-amino-4-sulfamil butanoico) es un aminoácido con un grupo sulfhidrilo libre; es el producto intermedio del metabolismo de la metionina en la síntesis de cisteína, la vía es bidireccional (transmetilación-remetilación) y está relacionada con el ácido fólico (vitamina B9) y con las vitaminas B1, B2, B6 y B12 como cofactores.1,2,3,24,31,32,40,45,54,57,87 Figura 1

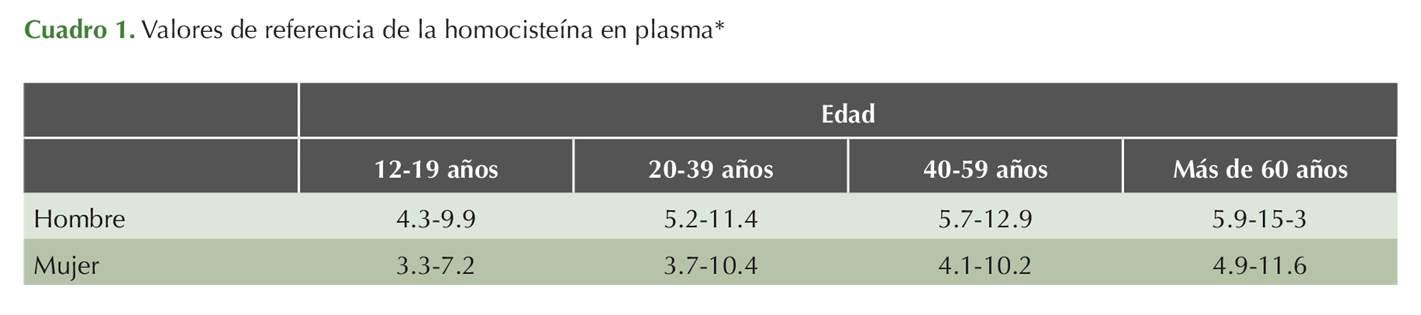
Los valores de referencia en plasma se incrementan con la edad y son mayores en el hombre.4 Cuadro 1
Para llevar a cabo la cuantificación sérica de la homocisteína, las técnicas inmunológicas son las más adecuadas, y entre las más utilizadas están: los inmunoensayos enzimáticos, el inmunoensayo de polarización fluorescente y la cromatografía de masas, que se considera el patrón de referencia para esta prueba. Se utiliza preferentemente plasma con ácido etilendiaminotetraacético (EDTA) como anticoagulante, aunque también puede usarse citrato o heparina. Entre los factores que pueden influir en el resultado está la lipemia.3,5,23,27,31 La sangre debe centrifugarse dentro de los primeros 30 minutos para evitar la falsa elevación causada por la liberación de homocisteína de los eritrocitos, pues esto aumenta la concentración en un 10% cada hora.
La hiperhomocisteinemia puede clasificarse en tres grados. Cuadro 2

En términos generales, la mayor parte de los laboratorios considera los siguientes valores de referencia: hombres: < 13 µmol/L, mujeres: 10.1 y niños menores de 14 años: 11.3; en 2005 se propuso una subdivisión de los valores plasmáticos que no tiene en cuenta la edad ni el sexo de los sujetos: valores normales: < 13 µmol/L, valores moderadamente elevados: 13-60, valores fuertemente elevados: > 60.90
En orina, los valores de referencia son 0.46-1.85 nmol homocisteína/mol creatinina (1 mol de creatinina = 113 g)25 o 0-9 µmol/g creatinina.
Las concentraciones de homocisteína en plasma, en el embarazo, son menores a los de las no gestantes,78,79 sobre todo en el segundo trimestre (Cuadro 3),70 por lo que para establecer el diagnóstico de hiperhomocisteinemia durante el embarazo se toman cifras mayores de 12 µmol/L.80

Para la detección de hiperhomocisteinemia, puede realizarse una prueba de carga de metionina: después de un ayuno de 10-12 horas, se ingieren 100 mg/kg de metionina y se toman muestras sanguíneas a las 0, 2, 4, 8, 12 y 24 horas27 o a las 4, 6 y 8 horas82 para comparar las concentraciones de vitaminas B y de aminoácidos.
FACTOR DE RIESGO CARDIOVASCULAR
• La importancia metabólica de la homocisteína puede resumirse como sigue:31
• Reciclamiento del folato intracelular.
• Catabolismo de colina.
• Catabolismo de betaína.
• Formación de cistationina.
• Formación de cisteína.
La hiperhomocisteinemia como factor de riesgo cardiovascular fue identificado por primera vez por McCully en 196983 al observar un aumento de eventos tromboembólicos, incluidos el infarto del miocardio y el ictus, en pacientes con homocistinuria que se había descrito en 1962,84 un déficit hereditario (OMIM 236200, gen 21q22.3) de cistationina β sintetasa, en donde puede haber concentraciones séricas de homocisteína de 100-300 µmol/L; la prevalencia de esta enfermedad en todo el mundo es de 1 en 200,000 a 1 en 350,000 nacidos vivos, aunque puede ser más común en algunas partes del mundo (por ejemplo en Qatar es de 1 en 1800 o en Irlanda es de 1 en 40,000-65,000).8,46,54 Se han identificado en total nueve tipos de homocistinuria desde los puntos de vista bioquímico y clínico, siendo la primeramente descrita (llamada clásica) la más frecuente.3,5,6,7,9,31,56 Además de los problemas tromboembólicos, en la homocistinuria hay frecuentemente fenotipo marfanoide, retardo mental, osteoporosis y luxación del cristalino.85 Existen directrices generales para el tratamiento de las homocistinurias de la Red y Registro Europeos de Homocistinurias y Defectos de la Metilación.58
La hiperhomocisteinemia tiene asociación independiente con la aparición de ateroesclerosis y tromboembolismo recurrente.29,33,35 En los casos de hiperhomocisteinemia, el riesgo relativo de infarto de miocardio es de 1.7-3.4, de ictus es de 2.5 y de vasculopatía periférica es de 6.8. Se encuentran valores elevados de homocisteína en más del 20% de los pacientes con enfermedad aterosclerótica, incluida la vasculopatía periférica y la enfermedad vascular pulmonar.5,28,39,54 Los individuos homocigotos para la variante genética MTHFR 677 TTa pueden tener un riesgo 16% mayor de cardiopatía coronaria en relación con grupos control.5,23 Un incremento de 5 mmol/L en la homocisteína plasmática puede aumentar el riesgo coronario en un 25 al 30%, una proporción similar a la que produce una elevación de 20 mg/dL del colesterol sérico.30 El aumento del riesgo que se relaciona con la concentración elevada de homocisteína en el plasma es similar en magnitud al que causan el tabaquismo y la hiperlipidemiab.48
Las implicaciones clínicas de la hiperhomocisteinemia pueden agruparse de la siguiente manera:30
Aterotrombosis: infarto agudo de miocardio, progresión de enfermedad coronaria conocida, estenosis carotídea, enfermedad vascular cerebral isquémica,89 enfermedad arterial periférica.
Enfermedad tromboembólica venosa: trombosis venosa profunda, trombosis venosa cerebral, tromboembolismo pulmonar, isquemia mesentérica, síndrome de Budd-Chiari, enfermedad vascular cerebral.
Complicaciones obstétricas: preeclampsia grave,50 desprendimiento prematuro de placenta, retardo en el crecimiento fetal, parto pretérmino, defectos del tubo neural, aborto de repetición.81
Sistema óseo: la hiperhomocisteinemia está determinada como factor de riesgo potencial de osteoporosis.51
Enfermedades psiquiátricas.82
FISIOPATOLOGÍA
La hiperhomocisteinemia implica diversas acciones: altera la liberación de óxido nítrico a partir de las células endoteliales, estimula la proliferación de las células musculares lisas aterógenas y aumenta la oxidación de las LDL, por disminución de la formación de glutatión y acumulación de radicales libres, contribuye a la trombogénesis por activación de la proteína C y de las plaquetas, altera factores de la coagulación (por ejemplo, V, VII, XII, von Willebrand, hístico), inhibe la adherencia endotelial del t-PA, genera peróxido de hidrógeno con toxicidad celular directa, inhibe la síntesis y secreción de prostaciclina, interfiere en el metabolismo del ácido araquidónico, con aumento de la producción de tromboxano A2, inhibe la expresión endotelial de la trombomodulina, suprime la expresión endotelial del proteoglucano sulfato de heparán y afecta la actividad de unión a la antitrombina III del heparán, inhibe el transporte intracelular de proteínas, inhibe la actividad de la ectoadenosina difosfatasa (ADPasa) en la superficie de las células endoteliales, y forma enlaces tioéster entre metabolitos de la homocisteína y distintas proteínas, como el fibrinógeno.3,5,9,28,36,44,46,48,49,54,65
CAUSAS SECUNDARIAS DE HIPERHOMOCISTEINEMIA
El síndrome de Down82 incrementa los valores de homocisteínac, al igual que: la posmenopausia, hipotiroidismo, insuficiencias renal y hepática, lupus eritematoso sistémico, diabetes mellitus, enfermedad inflamatoria intestinal, neoplasias (leucemia linfoblástica aguda, cánceres de mama, ovario, páncreas), psoriasis, anemia perniciosa, vasculitis, enfermedad de Crohn, consumo de varios fármacos (corticosteroides, ciclosporina, fenitoína, metotrexato, trimetoprim, niacina, anticonceptivos con estrógenos, teofilina, carbamazepina, azaribina, óxido nitroso, óxido nítrico, colestiramina, colestipol, ácido nicotínico, isoniazida, fibratos, metformina, L-dopa, colestiramina, IBPs, anti-H2, niacina, fenobarbital, primidona, andrógenos, ciclosporina A, análogos de adenosina, creatina, sulfasalazina, cafeína), tabaquismo, ingesta crónica de alcohol, deficiencias nutricionales de ácido fólicod y de vitaminas B6 y B12, considerándose causa de dos terceras parte de los casos,40 mutaciones de la vitamina B12, dieta hiperproteica por aumento de consumo de metionina, y procesos agudos, considerándose un reactante de fase aguda, cirugía gastrointestinal,2,3,5,23,27,31,56,60,66,67,68,71,82 todas estas condiciones se asociaron con mayor riesgo de trombosis y embolismo.71
TRATAMIENTO REDUCTOR
Se han realizado varios ensayos prospectivos con distribución al azar a gran escala (VISP, NORVIT, HOPE-2, SEARCH, CSPPT, etc.) para analizar la respuesta a la administración de ácido fólico y de vitaminas B6 y B12.
En el ensayo Vitamin Intervention for Stroke Prevention (VISP)10 se trató a los pacientes con antecedente de ictus con dos posologías diferentes de ácido fólico y vitaminas B6 y B12; aunque se observó una reducción dependiente de la dosis en las concentraciones de homocisteína, no hubo diferencias en cuanto a los eventos vasculares en los dos grupos.
En los ensayos Norwegian Vitamin Trial (NORVIT) y en el Western Norway B Vitamin Intervention Trial11 se distribuyó al azar a los pacientes en cuatro grupos con antecedentes de infarto de miocardio para recibir: ácido fólico, vitamina B6 y vitamina B12; ácido fólico y vitamina B12; vitamina B6 sola, o placebo. Después de un periodo de 39-78 meses de seguimiento, la homocisteína disminuyó en un 25% en el grupo tratado con ácido fólico y vitamina B12; sin embargo, en estos pacientes no se apreciaron diferencias en la aparición de las variables principales de evolución: infarto de miocardio recurrente, ictus o muerte súbita por enfermedad coronaria, en comparación con los otros grupos de tratamiento. En el grupo tratado con los tres fármacos, hubo una tendencia marginal significativa hacia un porcentaje menor de ictus, pero también se observó una tendencia casi significativa hacia mayor porcentaje de infarto de miocardio.5
El ensayo Heart Outcomes Prevention Evaluation 2 (HOPE-2)12 fue un estudio mixto de prevención primaria y secundaria en pacientes con vasculopatía o diabetes a quienes se trató con ácido fólico, vitaminas B6 y B12 o placebo; aunque disminuyó significativamente la homocisteína con el tratamiento, no hubo diferencias significativas en las variables primarias de evolución: infarto de miocardio, ictus o muerte de causa cardiovascular, en comparación con el placebo; hubo una disminución marginalmente significativa de los casos de ictus en los tratados con las vitaminas B.
El Study of the effectiveness of additional reductions in cholesterol and homocysteine (SEARCH) es un ensayo con distribución al azar en 12,064 supervivientes de infarto de miocardio, en el que se analizan los resultados de la administración de simvastatina a dosis de 20 y 80 mg y de ácido fólico 2 mg más 1 mg de vitamina B12 en comparación con placebo; produciendo una reducción promedio de 3 a 4 µmol/L en la homocisteína; después de 6 años de seguimiento medio, la tasa general anual de los principales eventos vasculares es de aproximadamente el 3%.59
En The China Stroke Primary Prevention Trial (CSPPT),76 un estudio prospectivo con asignación al azar realizado en 20,702 adultos con hipertensión arterial, sin antecedente de ictus, se encontró que la administración combinada de enalapril y ácido fólico, en comparación con enalapril solo, redujo el riesgo de ictus en un 2.7% comparado con un 3.4% en el grupo control, sin diferencias significativas entre los dos grupos de tratamiento en las frecuencias de eventos adversos.
Las dosis de ácido fólico son habitualmente de 0.4 a 1, o de 5-10 mg cada 24 horas (las dosis más altas en pacientes con insuficiencia renal); dosis de 0.1 mg/día son insuficientes; las de vitamina B6 de 25-50 mg al día y de B12 de 400-1000 µg al día.2,5,13,31 La administración de folato cuando existe deficiencia de vitamina B12 puede llevar a anemia megaloblástica, por lo que previamente debe verificarse la concentración de vitamina B12.28 Si no hay respuesta a la piridoxina (como puede ser en la mutación G307S), hay que añadir betaína (trimetilglicina), 6-9 g al día de la forma anhidra o 12-18 g al día de la forma citrato, con el fin de que la homocisteína sea remetilada a metionina.40,41,88 También es útil complementar la dieta con cisteína.46
Para diferenciar entre deficiencia de ácido fólico y de vitamina B12 es útil la medición en sangre de ácido metilmalónico (valor de referencia: 70 a 270 nmol/L) y de homocisteína totale, la elevación de ambos indica deficiencia de vitamina B12 pero, si es únicamente de homocisteína, la deficiencia es de folatos;34,37 cuando hay deficiencia de folatos, para mayor precisión, es preferible medir los valores de ácido fólico intraeritrocitario (valores de referencia: 166-940 ng/mL).34
La administración prolongada de vitamina B6 por periodos prolongados puede ocasionar neuropatía periférica42 y lesión hepática;43 en cuanto a la de ácido fólico o de vitamina B12, los resultados de inocuidad son controvertidos: un estudio concluyó que el ácido fólico a dosis de 1 mg al día no redujo el riesgo de adenoma colorrectal y que se necesita más investigación para ver la posibilidad de que la administración complementaria de ácido fólico aumente el riesgo de neoplasia colorrectal.18 Otro estudio evidenció que el tratamiento con ácido fólico más vitamina B12 se asoció con aumento en los resultados de cáncer y la mortalidad por todas las causas en pacientes con cardiopatía isquémica en Noruega.19 En un estudio previo59 se había encontrado que, aunque las reducciones sustanciales a largo plazo en las concentraciones de homocisteína en sangre con suplementos de ácido fólico y vitamina B12 no habían tenido efectos benéficos en los resultados vasculares, tampoco se habían asociado con efectos adversos en la incidencia de cáncer; algo similar encontró un estudio posterior al demostrar que la administración complementaria de ácido fólico no aumenta o disminuye sustancialmente la incidencia de cáncer en general, o en algún sitio específico durante los primeros cinco años de tratamiento.75 Se ha reportado también que la administración de folato puede aumentar el riesgo de reestenosis coronaria en el stent.62
HIPERHOMOCISTEINEMIA Y ENFERMEDADES NEUROLÓGICAS DEGENERATIVAS
En cuanto a la hiperhomocisteinemia y la enfermedad de Alzheimer, se ha encontrado correlación entre el diagnóstico confirmado de enfermedad de Alzheimer, elevación de concentración de homocisteína y disminución de las concentraciones de folatof y vitamina B12.47,63 En un estudio15 se encontró que tras realizar una determinación inicial de la homocisteína, las personas que incrementaban una desviación estándar sobre la media de la determinación basal tenían un riesgo relativo de 1.8 de padecer enfermedad de Alzheimer; sin embargo, en una revisión16 de ocho estudios con distribución al azar, doble ciego, frente a placebo en ancianos sanos y con demencia, no hubo evidencias de los beneficios de la administración complementaria de ácido fólico con o sin vitamina B12 como factor preventivo de demencia en ancianos sanos. No obstante, un metanálisis que incluyó 8669 personas17 parece confirmar los efectos benéficos de la vitamina B12 y el ácido fólico, encontrando asociación entre la hiperhomocisteinemia y la demencia, con riesgo de 1.35 por cada 5 µmol/L de aumento de la homocisteína; del mismo modo, la reducción media de la misma de 3 μmol/L, que se obtiene con la administración complementaria de ácido fólico y vitamina B12, conlleva disminución del riesgo de demencia de 0.78. De tal manera que la disminución de la hiperhomocisteinemia con ácido fólico y vitaminas B, aunque no reduzca la aterosclerosis temprana, podría interferir en el deterioro cognitivo y en la enfermedad de Alzheimer.69
La homocisteína actúa como agonista del receptor de glutamato N-metil-D-aspartato; esta sobreestimulación contribuiría a la patogenia de los síntomas neurológicos.46 La homocisteína también juega un papel importante en la fisiopatología y en la morbilidad y mortalidad de los enfermos con enfermedad de Parkinson.52
DISCUSIÓN Y CONCLUSIONES
Por el momento, la hiperhomocisteinemia sí tiene evidencias de que puede considerarse un factor de riesgo cardiovascular independiente, pero el tratamiento que la normaliza no ha mostrado beneficios substancialesg,20,21,22 y en algunos casos hay la posibilidad de efectos adversos, por lo que no cabe recomendar este tratamiento.5 Quizá deba implementarse la medición rutinaria de las concentraciones séricas de homocisteína, pues una elevación moderada de ésta puede encontrarse en el 5 al 7% de la población general.28 Desde el punto de vista práctico, en este momento se recomienda medirla y estudiarla en los pacientes con eventos coronarios sin otros factores de riesgo que lo expliquen y podría extenderse este estudio a los pacientes en edades tempranas.53 La llamada “controversia sobre la homocisteína”72 señala que la duración del seguimiento en la mayor parte de los estudios ha sido demasiado corta, el punto es que tales expectativas no son realistas para la aterosclerosis porque la placa aterosclerótica generalmente tarda 30 a 40 años en convertirse en un evento clínico completo. Además, existe una clara diferencia entre la prevención primaria de las primeras etapas de un proceso de enfermedad y los intentos de intervenir después de un daño vascular demostrado (prevención secundaria). A pesar de que la terapia para reducir la homocisteína ha fracasado en varios ensayos relacionados con la prevención secundaria de la enfermedad aterosclerótica, esto no ha eliminado la posibilidad de un papel benéfico para reducir la homocisteína en la prevención primaria de enfermedades.73 En opinión de algunos, por el momento, la homocisteína puede servir como marcador de enfermedad coronaria y vascular, en lugar de un factor causal.74
REFERENCIAS
1. Rodwell VW. Biosynthesis of the nutritionally nonessential aminoacids. En: Rodwell VW, Bender DA, Botham KM, Kennelly PJ, Weil PA. Harper’s. Illustrated Biochemestry. New York: McGraw-Hill Education, 2018: 643-660.
2. Clark D. Tromboembolismo venoso y estados hipercoagulables/Factores de riesgo cardiovascular no lipídicos. En: Griffin BP, Menon V (ed.). Manual de Medicina Cardiovascular. Barcelona: Wolters Kluwer; 2020: 386-637.
3. Castillo TNP, Moreno LLC, Munive LMR, Souto RMG, Saturno CG, García JY, Santiago HJ. Laboratorio clínico ante el paciente cardiológico. Cardiopatía isquémica crónica. En: Ruesga ZEA, Saturno CG, eds. Cardiología. México: El Manual Moderno; 2011: 158-159,962.
4. Selhub J, Jacques PF, Rosenberg IH, Rogers G, Bowman BA, Gunter EW, et al. Serum total homocysteine concentrations in the Third National Health and Nutrition Examination Survey (1991-1994): Population reference ranges and contribution of vitamin status to high serum concentrations. Ann Intern Med 1999; 131 (5): 331-339. doi: 10.7326/0003-4819-131-5-199909070-00003.
5. Solaiman FA, Kim ESH, Cauthen CA, Grasso AW. Tromboembolia venosa y estados de hipercoagulación. Factores de riesgo cardiovascular no dislipidémicos. En: Griffin BP (ed.). Manual de Medicina Cardiovascular. Barcelona: Wolters Kluwer Health España; 2013: 456,727-728.
6. Costa K. Hematología. Estados de hipercoagulabilidad. En: Hughes HK, Kahl LK. The Johns Hopkins Hospital. Manual Harriet Lane de Pediatría. Barcelona: Elsevier; 2018: 379.
7. Corona RJR. Genética. Homocistinuria. En: Rivera MR (dir.). Pediatría. Salud y enfermedad del niño y del adolescente. México: Federación de Pediatría del Centro, Occidente de México, Confederación Nacional de Pediatría de México, El Manual Moderno; 2017: 588.
8. Shchelochkov OA, Venditti CP. Methionine. Homocystinuria (homocystinemia). En: Kliegman RM, St Geme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM, et al. Nelson. Textbook of Pediatrics. Philadelphia, PA: Elsevier; 2020: 703-706.
9. Welch GN, Loscalzo J. Homocysteine and atherothrombosis. N Engl J Med 1998; 338 (15): 1042-1050. doi: 10.1056/NEJM199804093381507.
10. Toole JF, Malinow MR, Chambless LE, Spence JD, Pettigrew LC, Howard VJ, et al. Lowering homocysteine in patients with ischemic stroke to prevent recurrent stroke, myocardial infarction, and death: The Vitamin Intervention for Stroke Prevention (VISP) randomized controlled trial. JAMA 2004; 291 (5): 565-575. doi: 10.1001/jama.291.5.565.
11. Ebbing M, Bønaa KH, Arnesen E, Ueland PM, Nordrehaug JE, Rasmussen K, et al. Combined analyses and extended follow-up of two randomized controlled homocysteine-lowering B-vitamin trials. J Intern Med 2010; 268 (4): 367-382. doi: 10.1111/j.1365-2796.2010.02259.x.
12. Lonn E, Yusuf S, Arnold MJO, Sheridan P, McQueen MJ, Pogue J, et al. Homocysteine lowering with folic acid and B vitamins in vascular disease. The Heart Outcomes Prevention Evaluation (HOPE) 2 Investigators. N Engl J Med 2006; 354 (15): 1567-1577. doi: 10.1056/NEJMoa060900.
13. Guadalajara JF. Cardiología. México, Méndez Editores, 2018: 905, 948, 1017.
14. Blaha MJ, Ketlogetswe KS, Ndumele CE, Gluckman TJ, Blumenthal RS. Dislipidemia y otros factores de riesgo cardiacos. En: Walsh RA, Fang JC, Fuster V. Hurst. El corazón. Manual de Cardiología. México: McGraw-Hill Interamericana; 2014: 233.
15. Seshadri S, Beiser A, Selhub J, Jacques PF, Rosenberg IH, D’Agostino RB, et al. Plasma homocysteine as a risk factor for dementia and Alzheimer’s disease. N Engl J Med 2002; 346: 476-483. doi: 10.1056/NEJMoa011613.
16. Malouf R, Grimley EJ. Folic acid with or without vitamin B12 for the prevention and treatment of healthy elderly and demented people. Cochrane Database Syst Rev 2008;4:CD004514. doi: 10.1002/14651858.CD004514.pub2.
17. Wald DS, Kasturiratne A, Simmonds M. Serum homocysteine and dementia: meta-analysis of eight cohort studies including 8,669 participants. Alzheimers Dement 2011; 7 (4): 412-417. doi: 10.1016/j.jalz.2010.08.234.
18. Cole BF, Baron JA, Sandler RS, Haile RW, Ahnen DJ, Bresalier RS, et al. Folic acid for the prevention of colorectal adenomas: a randomized clinical trial. JAMA 2007; 297 (21): 2351-2359. doi: 10.1001/jama.297.21.2351.
19. Ebbing M, Bønaa KH, Nygård O, Arnesen E, Ueland PM, Nordrehaug JE, et al. Cancer incidence and mortality after treatment with folic acid and vitamin B12. JAMA 2009; 302 (19): 2119-2126. doi: 10.1001/jama.2009.1622.
20. Martí-Carvajal AJ, Solà I, Lathyris D, Salanti G. Homocysteine lowering interventions for preventing cardiovascular events. Cochrane Database Syst Rev. 2009. doi: 10.1002/14651858.CD006612.pub2.
21. Miller ER, Juraschek S, Pastor-Barriuso R, Bazzano LA, Appel LJ, Guallar E. Meta-analysis of folic acid supplementation trials on risk of cardiovascular disease and risk interaction with baseline homocysteine levels. Am J Cardiol 2010; 106 (4): 517-527. doi: 10.1016/j.amjcard.2010.03.064.
22. Lee M, Hong KS, Chang SC, Saver JL. Efficacy of homocysteine-lowering therapy with folic acid in stroke prevention: a meta-analysis. Stroke 2010; 41 (6): 1205-1212. doi: 10.1161/STROKEAHA.109.573410.
23. Ridker PM, Libby P, Buring JE. Risk markers and the primary prevention of cardiovascular disease. Homocysteine. En: Zipes DP, Libby P, Bonow RO, Mann DL, Tomaselli GF. Braunwald’s Heart Disease. A textbook of cardiovascular medicine. Philadelphia, PA: Elsevier; 2019: 894.
24. Saturno CG. Cardiología. México: El Manual Moderno; 2017: 248,357-358.
25. Gómez GA, Casas GMC. Interpretación clínica del laboratorio. Bogotá: Panamericana; 2014: 330.
26. Feliu J, Panizo C, Marcos M, Rifón J. El laboratorio en las enfermedades hematológicas, en: Prieto VJM, Yuste AJR. Balcells. La clínica y el laboratorio. Barcelona: Elsevier; 2019: 706-707.
27. Pagana KD, Pagana TJ, Pagana TN. Mosby’s Diagnostic and Laboratory Test Reference. St. Louis Missouri: Elsevier; 2019: 513-514.
28. Osuna AMM. Nuevos factores de riesgo cardiovascular. Homocisteína. En: Vargas BJ. Tratado de Cardiología. México: Sociedad Mexicana de Cardiología-Intersistemas; 2006: 145.
29. Nygard O, Nordreahaug JE, Refsum H, Ucland PM, Farstad M, Vollset SE. Plasma homocysteine levels and mortality in patients with coronary artery disease. N Engl J Med 1997; 337 (4): 230-236. doi: 10.1056/NEJM199707243370403.
30. Boushey CJ, Beresford SA, Omenn GS. A quantitative assessment of plasma homocysteine as a risk factor for vascular disease probable benefits of increasing folic acid intakes. JAMA 1995; 274 (13): 1049-1057. doi: 10.1001/jama.1995.03530130055028.
31. Matadamas ZC, Pérez CE, Hernández JJ, Majluf CA. Nuevos factores de riesgo cardiovascular: hiperhomocisteinemia. Rev Med IMSS 2003; 41 (3): 235-249.
32. Farías MG. Metabolismo de las proteínas. En: Manual de Bioquímica. Guadalajara: Universidad Autónoma de Guadalajara; 1972: 434-435.
33. Martínez C, Vargas G. Cardiología preventiva. Factores de riesgo coronario. En: Martínez RMA (edit.). Tratado de Cardiología del Instituto Nacional de Cardiología Ignacio Chávez. México: Global Medical Comunication; 2019: 263-266.
34. León GMG, Gutiérrez RM. Anemias megaloblásticas. En: Gutiérrez RM. Síndromes hematológicos, su relación con las enfermedades que los producen. México: Prado; 2014: 248.
35. Páramo FJA. Enfermedad tromboembólica arterial. En: Soto OI, Álvarez RMT (ed.). Hemorragia y trombosis en la práctica clínica. Madrid: Sociedad Española de Trombosis y Hemostasia-Ergon; 2018: 416.
36. Marfil RLJ. Estado hipercoagulable. Trombofilia. En: Jaime PJC, Gómez AD. Hematología. La sangre y sus enfermedades. México: McGraw-Hill Interamericana; 2015: 174.
37. Romero GF, Rodríguez CJ. Anemias megaloblásticas. En: Ruiz AGJ, Ruiz DGJ. Fundamentos de Hematología. México: Médica Panamericana; 2014: 59-60.
38. Pintó SX. La homocisteína como factor de riesgo cardiovascular. Med Integr 2000; 36 (5): 179-185.
39. Fritsma GA. Evaluación del riesgo trombótico, en: Rodak BF, Fritsma GA, Keohane EM. Hematología. Fundamentos y aplicaciones clínicas. México: Médica Panamericana; 2014: 788-790.
40. Gil HA (dir.). Tratado de Nutrición. Madrid: Médica Panamericana; 2017: passim.
41. Elsas LJ II, Acosta PB. Apoyo nutricional en la enfermedad metabólica hereditaria. Aminoácidos que contienen azufre. En: Shils ME, Olson JA, Shike M, Ross AC (ed.). Nutrición en salud y enfermedad. México; McGraw-Hill Interamericana; 2002; II: 1190-1196.
42. Schaumburg H, Kaplan J, Windebank A, Vick N, Rasmus S, Pleasure D, et al. Sensory neuropathy from pyridoxine Abuse — A new megavitamin syndrome. N Engl J Med 1983; 309 (8): 445-448. doi: 10.1056/NEJM198308253090801.
43. Yoshida I, Sakaguchi Y, Nakano M, Yamashita F, Hitoshi T. Pyridoxal phosphate-induced liver injury in a patient with homocystinuria. J Inherit Metab Dis 1985; 8 (2): 91. doi: 10.1007/BF01801674.
44. Lazenby RB. Sistema cardiovascular. Causas de ateroesclerosis. En: Fisiopatología. México: El Manual Moderno; 2012: 528.
45. Mefford LC. Alteraciones del flujo sanguíneo y la regulación de la presión arterial. En: Norris TL. Porth. Fisiopatología. Alteraciones de la salud, conceptos básicos. Philadelphia, PA: Wolters Kluwer; 2019: 726-727.
46. Menkes JH. Trastornos del metabolismo de los aminoácidos. En: Rowland LP, Pedley TA. Neurología de Merrit. Philadelphia, PA: Lippincott Williams & Wilkins; 2010: 605-608.
47. Clarke R, Smith AD, Jobst KA, Refsum H, Sutton L, Ueland PM. Folate, vitamin B12, and serum total homocysteine levels in confirmed Alzheimer disease. Arch Neurol 1998; 55 (11): 1449-1455. doi: 10.1001/archneur.55.11.1449.
48. Gotlieb AI, Liu A. Vasos sanguíneos. En: Strayer DS (ed.). Rubin y Strayer. Patología. Philadelphia, PA: Wolters Kluwer; 2015: 595-596.
49. Kumar V, Abbas AK, Aster JC. Trastornos hemodinámicos, enfermedad tromboembólica y shock. En: Robbins y Cotran. Patología estructural y funcional. Barcelona: Elsevier; 2015: 124.
50. Martínez-Herrera FJ, Polo-Soto S, Chacón-Calderón AE, Ibarra-Herrera JE, Pérez-García O. Asociación de los niveles séricos de homocisteína y preeclampsia. Rev Sanid Milit Mex 2002; 56 (5): 216-219.
51. Morales GM. Homocisteína y metabolismo óseo. Residente 2009; 4 (1): 13-17.
52. Martínez LE, Martínez HR, Del Roble VM, Sampallo E, Aguirre RA, González HC, y cols. Niveles séricos de homocisteína en enfermedad de Parkinson. Rev Mex Neuroci 2003; 4 (6): 413-418.
53. Barrera CE. Enfermedad isquémica. Evento coronario agudo. En: Chalem F, Campos J, Esguerra R, Chalem P. Tratado de Medicina Interna. Bogotá: Celsus; 2005; I: 333.
54. Rodés TJ, Guardia MJ. Medicina Interna. Barcelona: Masson; 2004; I: 890/II: 2649, 3198.
55. Gil de Extremera B. Factores de riesgo cardiovascular. En: Rozman C, Cardellach F (dir.). Farreras I Rozman. Medicina Interna. Barcelona: Elsevier; 2020; I: 472.
56. Hoffbrand AV, Longo N. Anemias megaloblásticas. Trastornos hereditarios del metabolismo de aminoácidos en adultos. En: Jameson JL, Fauci AS, Kasper DL, Hauser SL, Longo DL, Loscalzo J (ed.). Harrison. Principios de Medicina Interna. México: McGraw-Hill Education; 2018: 1-22: 702-3018.
57. Schiff M, Blom H. Homocistinuria e hiperhomocisteinemia. En: Goldman L, Schafer AI, Goldman-Cecil. Tratado de Medicina Interna. Barcelona: Elsevier; 2017; 2: 1405-1409.
58. European Network and Registry for Homocystinurias and Methylation Defects (http://www.e-hod.org) (consultado el 10 de marzo de 2020).
59. Bowman L, Armitage J, Bulbulia R, Parroquia de S, Collins R. Study of the effectiveness of additional reductions in cholesterol and homocysteine (SEARCH) Collaborative Group. Effects of homocysteine-lowering with folic acid plus vitamin B12 vs placebo on mortality and major morbidity in myocardial infarction survivors. A Randomized Trial. JAMA 2010; 303 (24): 2486-2494. doi: 10.1001/jama.2010.840.
60. Deitcher S. Estados hipercoagulables, en: Carey WD. Diagnóstico clínico y tratamiento de Cleveland Clinic. México: El Manual Moderno; 2012: 591.
61. Zhou A, Regenboen T, Jackups R, Blinder M. Trastornos hematológicos y tratamiento transfusional. Anemia macrocítica megaloblástica. En: Bhat P, Dretier A, Gdowski M, Ramgopal R, Williams D (ed.). Manual Washington ® de Terapéutica Médica. Philadelphia, PA: Wolters Kluwer; 2017: 655.
62. Lange H, Suryapranata H, De Luca G, Börner C, Dille J, Kallmayer K, et al. Folate therapy and in-stent restenosis after coronary stenting. N Engl J Med 2004; 350 (26): 2673-2681. doi: 10.1056/NEJMoa032845.
63. Gil NE. Biomarcadores y enfermedad de Alzheimer. En: Alberca R, López-Pousa S. Enfermedad de Alzheimer y otras demencias. Madrid: Médica Panamericana; 2002: 306.
64. Carmel R. Megaloblastic anemias: Disorders of impaired DNA synthesis. En: Greer JP, Rodgers GM, Glader B, Arber DA, Means RT, List AF, et al. Wintrobe’s Clinical Hematology. Philadelphia, PA: Wolters Kluwer; 2019: 932.
65. Mandava P. Homocystinuri. Homocysteinemia. Medscape® 2018 jul. 27 (https://emedicine.medscape.com/article/1952251-overview), (consultado el 11 de marzo de 2020).
66. Rosenson RS, Smith C, Bauer KA. Overview of homocysteine. UptoDate® 2019 nov. 13 (Topic 6837 Version 42.0).
67. Townsley DM, Rodgers GP. Deficiencia de vitamina B12 y folato. En: Rodgers GP, Young NS. Bethesda. Manual de Hematología. Barcelona: Wolters Kluwer; 2019: 37.
68. Nicoli D, Mark LC, McPhee SJ. Guía para las pruebas diagnósticas. México: McGraw-Hill Interamericana; 2018: 156.
69. Cacciapuoti F. Lowering homocysteine levels with folic acid and B-vitamins do not reduce early atherosclerosis but could interfere with cognitive decline and Alzheimer’s disease. J Thromb Thrombolysis 2013; 36 (3): 258-262. doi: 10.1007/s11239-012-0856-x.
70. Walker MC, Smith GN, Perkins SL, Keely EJ, Garner PR. Changes in homocystein levels during normal pregnancy. Am J Obstet Gynecol 1999; 180 (3): 660-664. doi: 10.1016/s0002-9378(99)70269-3.
71. Weinblat ME. Hemorrhage and thrombosis, en: Friedman SB, Fisher MM, Kenneth SS, Alderman EM. Comprehensive Adolescent Health Care. St. Louis, Missouri: Mosby-Year Book; 1998: 445.
72. Smulders YM, Blom HJ. The homocysteine controversy. J Inherit Metab Dis 2011; 34 (1): 93-99. doi: 10.1007/s10545-010-9151-1.
73. Aśok CA. Megaloblastic anemias. En: Hoffman R, Benz EJ, Silberstein LE, Heslop HE, Weitz JI, Anastasi J. Hematology. Basic principles and practice. Philadelphia, PA: Elsevier; 2018: 544-545.
74. Park D. Peripheral vascular disease. En: Rakel D. Integrative Medicine. Philadelphia, PA: Elsevier; 2012: 239.
75. Vollset SE, Clarke R, Lewington S, Ebbing M, Halsey J, Lonn E, et al. Effects of folic acid supplementation on overall and site-specific cancer incidence during the randomised trials: meta-analyses of data on 50 000 individuals. Lancet 2013; 381 (9871): 1029-1036. doi: 10.1016/S0140-6736(12)62001-7.
76. Huo Y, Li J, Qin X, Huang Y, Wang X, Gottesman RF, et al. Efficacy of folic acid therapy in primary prevention of stroke among adults with hypertension in China. The CSPPT Randomized Clinical Trial. JAMA 2015; 313 (13): 1325-1335. doi: 10.1001/jama.2015.2274.
77. Kupferminc MJ, Eldor A, Steinman N, Many A, Bar-Am A, Jaffa A, et al. Increased frequency of genetic thrombophilia in women with complications of pregnancy. N Engl J Med 1999; 340 (1): 9-13. doi: 10.1056/NEJM199901073400102.
78. López-Quesada E, Vilaseca MA, Lailla JM. Plasma total homocysteine in uncomplicated pregnancy and in preeclampsia. Eur J Obstet Gynecol Reprod Biol 2003; 108 (1): 45-49. doi: 10.1016/s0301-2115(02)00367-6.
79. McDonald SD, Walker MC. Homocysteine levels in pregnant women who smoke cigarettes. Med Hypotheses 2001; 57 (6): 792-796. doi: 10.1054/mehy.2001.1495.
80. Lockwood CJ. Inherited thrombophilias in pregnant patients: Detection and treatment paradigm. J Obstet Gynecol 2002; 99 (2): 333-341. doi: 10.1016/s0029-7844(01)01760-4.
81. Nelen WL, Blom HJ, Steegers EA, den Heijer M, Tom KA. Hyperhomocysteinemia and recurrent early pregnancy loss: a meta-analysis. Fertil Steril 2000; 74 (6): 1196-1199. doi: 10.1016/s0015-0282(00)01595-8.
82. Rodríguez-Pérez A, Muñoz-Delgado G. Homocisteína. En: Rodríguez GJL (dir. gral.). Medicina Interna (Green Book). Grupo Científico D.T.M.®-Madrid: Marbán Libros, 2015; 3: 1898-1901.
83. McCully KS. Vascular pathology of homocysteinemia: implications for the pathogenesis of arteriosclerosis. Am J Pathol 1969; 56: 111-128.
84. Carson NA, Neill DW. Metabolic abnormalities detected in a survey of mentally backward individuals in Northern Ireland. Arch Dis Child 1962; 37: 505-513. doi: 10.1136/adc.37.195.505.
85. Espinosa GE. Neuropediatría, en: Toro GJ, Yepes SM, Palacios SE. Neurología. México: El Manual Moderno; 2010: 794.
86. DeBusk R. Clínica: genómica nutriciona. En: Kathleen ML, Raymond JL. Krause. Dietoterapia. Barcelona: Elsevier; 2013: 310.
87. Nelson DL, Cox MM. Oxidación de aminoácidos y producción de urea. En: Bioquímica. Omega: Lehninger; 2017: 691.
88. Porter RS (dir.). Trastornos hereditarios del metabolismo. En: El Manual Merck de diagnóstico y tratamiento. Buenos Aires: Médica Panamericana; 2020: 2650-2651.
89. Eikelboom JW, Hankey GJ, Anand SS, Lofthouse E, Staples N, Baker RI. Association between high homocyst(e)ine and ischemic stroke due to large- and small-artery disease but not other etiologic subtypes of ischemic stroke. Stroke 2000; 31 (5): 1069-1075. doi: 10.1161/01.str.31.5.1069.
90. Gulletta E. Aparato cardiovascular. Los factores de riesgo cardiovascular. Homocisteína. En: Antonozzi I, Gulletta E. Medicina de laboratorio. Fundamentos y aplicaciones en el diagnóstico clínico. México: Médica Panamericana; 2016: 234.
_____________________________________________
a En 1988 se describió la variante termolábil MTHFR C677T,26 presente en el 10% de los individuos de raza caucásica, en un 20 al 30% de los pacientes con enfermedad vascular53 y en un 8% de las mujeres embarazadas.77
b Hay quien dice que: “…en sujetos…con cifras elevadas de homocisteína (> 15 µmol/L) no se ha demostrado que tengan mayor predisposición de enfermedades cardiovasculares…” (13, pág. 905).
c Contrariamente, otros dicen que en el síndrome de Down y en el hipertiroidismo se encuentran valores menores a los intervalos de referencia.68
d En Estados Unidos, desde 1998, existe la fortificación obligatoria con 140 μg de ácido fólico/100 g de cereales para reducir el riesgo de nacimientos con defectos del tubo neural,64 riesgo presente en estados de hiperhomocisteinemia.86
e La homocisteína total es la suma de las concentraciones de homocisteína unida a proteínas (el 80% del total) y la libre. La homocisteína libre se encuentra en forma oxidada, la cual se combina en sí misma para formar el dímero homocistina, y con cisteína para formar la forma disulfuro mixta cisteína-homocisteína. La forma reducida no unida a proteínas constituye el 1% de la concentración plasmática total de homocisteína.38
f Hay quien dice que: “…la deficiencia de ácido fólico no causa enfermedad neurológica…”61 (en negritas en el original).
g Hay quien afirma que: “…el uso de ácido fólico disminuye los valores de homocisteína y de cardiopatía isquémica (18%), trombosis venosa (25%) e ictus cerebral (24%)…”55 o que “…los metanálisis indicaron un descenso del 18% de la frecuencia de apoplejías…”.56
Recibido: 2 de agosto 2021
Aceptado: 3 de noviembre 2021
Este artículo debe citarse como: Murillo-Godínez G. Homocisteína, otro factor de riesgo cardiovascular. Med Int Méx 2022; 38 (4): 903-913.
Sin comentarios